|
|
|
下列说法错误的是①NaHCO3溶液加水稀释,c(Na+)/c(<img【水的电离平衡】
2016-12-25 19:44:58
来源:91考试网
作者:www.91exam.org 【 大 中 小】
选择题 下列说法错误的是
①NaHCO3溶液加水稀释,c(Na+)/c(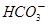 )的值保持增大 )的值保持增大
②浓度均为0.1mol·L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(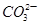 )+c( )+c(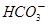 )] )]
③在0.1mol·L-1氨水中滴加0.1mol·L-1盐酸,恰好完全反应时溶液的pH=a,则由水电离产生的c(OH-)=10-a mol·L-1
④向0.1mol·L-1(NH4)2SO3溶液中加入少量NaOH固体,c(Na+)、c( )、c( )、c( )均增大 )均增大
⑤在Na2S稀溶液中,c(H+)=c(OH-)+2c(H2S)+c(HS-)
A.①④
B.②④
C.①③
D.②⑤
|
本题答案:B
本题解析:
试题分析:①加水稀释,碳酸氢根的水解程度增大,所以比值增大,正确;②在同业中遵循物料守恒,钠原子:碳原子=3:2,所以有2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)], 错误;③恰好完全反应时,溶液中的氢离子和氢氧根离子都是水电离的,所以溶液的pH=a,则溶液中的氢离子浓度=10-amol/L,则氢氧根离子浓度也为10-amol/L,正确;④加入氢氧化钠固体,促进铵根离子水解,抑制亚硫酸根离子水解,所以铵根离子浓度减小,亚硫酸根离子浓度增大,错误;⑤根据溶液中质子守恒,即水电离的氢离子和氢氧根离子浓度永远相等,可以写出c(H+)=c(OH-)+2c(H2S)+c(HS-),正确;所以选B。
考点:溶液的酸碱性和溶液中的离子浓度比较
本题所属考点:【水的电离平衡】
本题难易程度:【困难】
The worth of a thing is best known by the want of it. 缺乏一件东西时,才知道它的可贵.