微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (1)某温度下,纯水的[H+] =2.0×l0-7mol·L—l,则此时的[OH—]=__________。若温度不变,滴入稀硫酸使[H+] =5.0×l0-7mol·L—l.则[OH—]=_________,由水电离出的[H+]=__________。
(2)若l00℃时纯水电离出的[H+]为l.0×l0-6mol·L—l,此时Kw=__________。
填空题 (1)某温度下,纯水的[H+] =2.0×l0-7mol·L—l,则此时的[OH—]=__________。若温度不变,滴入稀硫酸使[H+] =5.0×l0-7mol·L—l.则[OH—]=_________,由水电离出的[H+]=__________。
(2)若l00℃时纯水电离出的[H+]为l.0×l0-6mol·L—l,此时Kw=__________。
本题答案:(1)2.0×10-7mol·L-1,8.0×10-8mol
本题解析:
试题分析:(1)H2O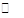 H++OH-,水电离出的c(H+)=c(OH-),则此时纯水中c(OH-)=2.0×10-7mol·L-1,此温度下的Kw=c(H+)×c(OH-)=2.0×10-7×2.0×10-7=4.0×10-14,温度不变,滴入稀硫酸,Kw不变,c(OH-)=
H++OH-,水电离出的c(H+)=c(OH-),则此时纯水中c(OH-)=2.0×10-7mol·L-1,此温度下的Kw=c(H+)×c(OH-)=2.0×10-7×2.0×10-7=4.0×10-14,温度不变,滴入稀硫酸,Kw不变,c(OH-)= =
=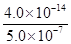 =8.0×10-8mol·L-1,酸性溶液中的OH-是由水电离产生的,且水电离产生H+和OH-的量相等,因此此溶液中水电离出的c(H+)=8.0×10-8mol·L-1;( 91eXaM.org2)水电离出c(H+)=c(OH-),Kw=c(H+)×c(OH-)=c2(H+)=1.0×10-12。
=8.0×10-8mol·L-1,酸性溶液中的OH-是由水电离产生的,且水电离产生H+和OH-的量相等,因此此溶液中水电离出的c(H+)=8.0×10-8mol·L-1;( 91eXaM.org2)水电离出c(H+)=c(OH-),Kw=c(H+)×c(OH-)=c2(H+)=1.0×10-12。
考点:考查水的电离和水的离子积等相关知识。
本题所属考点:【水的电离平衡】
本题难易程度:【一般】
He that is full of himself is very empty. 人若十分自恃,必定十分无知.