|
|
|
常温下,用0.1000mol/L NaOH溶液滴定 20.00mL 0.1000 mol/LC【弱电解质电离平衡】
2016-12-25 20:15:55
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 常温下,用0.1000mol/L NaOH溶液滴定 20.00mL 0.1000 mol/L
CH3COOH溶液滴定曲线如右图。下列说法正确的是
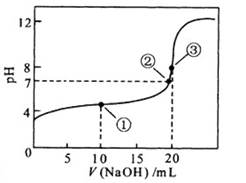
A.点①所示溶液中:c(CH3COO-)+ c(OH-) =c(CH3COOH)+ c(H+)
B.点②所示溶液中:c(Na+) =c(CH3COOH)+ c(CH3COO-)
C.点③所示溶液中:c(Na+)> c(OH-)> c(CH3COO-)> c(H+)
D.滴定过程中可能出现:c(CH3COOH)> c(CH3COO-)> c(H+)> c(Na+)> c(OH-)
|
选择题 常温下,用0.1000mol/L NaOH溶液滴定 20.00mL 0.1000 mol/L
CH3COOH溶液滴定曲线如右图。下列说法正确的是

A.点①所示溶液中:c(CH3COO-)+ c(OH-) =c(CH3COOH)+ c(H+)
B.点②所示溶液中:c(Na+) =c(CH3COOH)+ c(CH3COO-)
C.点③所示溶液中:c(Na+)> c(OH-)> c(CH3COO-)> c(H+)
D.滴定过程中可能出现:c(CH3COOH)> c(CH3COO-)> c(H+)> c(Na+)> c(OH-)
|
本题答案:D
本题解析:A 错 ①是醋酸钠和醋酸的混合液,c(CH3COO-)+ c(OH-) =c(Na+)+ c(H+)
B 错②PH="7," c(OH-) = c(H+),所以c(Na+) = c(CH3COO-)
C 错点③是氢氧化钠和醋酸钠的混合液,且氢氧化钠过量比较少,c(Na+)> c(CH3COO-)> c(OH-)>c(H+)
D 对在滴定初期,可能会 出现c(CH3COOH)> c(CH3COO-)> c(H+)> c(Na+)> c(OH-)
本题所属考点:【弱电解质电离平衡】
本题难易程度:【简单】
The best argument is that which seems merely an explanation. 最有力的争辩看上去只是一种解释.