微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
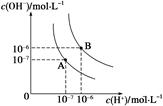
填空题 (1)水的电离平衡曲线如图所示,若A点表示25 ℃时水的电离达平衡时的离子浓度,B点表示95 ℃时水的电离达平衡时的离子浓度。则95℃时0.1 mol·L-1的NaOH溶液中,由水电离出的 c(H+)= mol·L-1,Kw(25 ℃) Kw(95℃)(填“>”、“<”或“=”)。25 ℃时,向水的电离平衡体系中加入少量NH4Cl 固体,对水的电离平衡的影响是 (填“促进”、“抑制”或“不影响”)。
(2)25℃时,在0.1L 0.2 mol·L-1的HA溶液中,有0.001mol的HA电离成离子,则该溶液的pH= ,电离度为 。
(3)电离平衡常数是衡量弱电解质电离程度强弱的量(已知如表数据)。向NaCN溶液中通入少量CO2,所发生反应的化学方程式为 。
化学式
| 电离平衡常数(25 ℃)
|
HCN
| K=4.9×10-10
|
H2CO3
| K1=4.3×10-7、K2=5.6×10-11
|
填空题 (1)水的电离平衡曲线如图所示,若A点表示25 ℃时水的电离达平衡时的离子浓度,B点表示95 ℃时水的电离达平衡时的离子浓度。则95℃时0.1 mol·L-1的NaOH溶液中,由水电离出的 c(H+)= mol·L-1,Kw(25 ℃) Kw(95℃)(填“>”、“<”或“=”)。25 ℃时,向水的电离平衡体系中加入少量NH4Cl 固体,对水的电离平衡的影响是 (填“促进”、“抑制”或“不影响”)。

(2)25℃时,在0.1L 0.2 mol·L-1的HA溶液中,有0.001mol的HA电离成离子,则该溶液的pH= ,电离度为 。
(3)电离平衡常 数是衡量弱电解质电离程度强弱的量(已知如表数据)。向NaCN溶液中通入少量CO2,所发生反应的化学方程式为 。
化学式
| 电离平衡常数(25 ℃)
|
HCN
| K=4.9×10-10
|
H2CO3
| K1=4.3×10-7、K2=5.6×10-11
|
本题答案:(1)1×10-11、 < 、 促进 (2)
本题解析:
试题分析:(1)由图中曲线可知,25℃时水的离子积Kw = c(H+) × c(OH-)=10-14 ,95℃时水的离子积Kw = c(H+) × c(OH-)=10-12 ,Kw(25 ℃)> Kw(95℃),且95℃的氢氧化钠溶液中,当c(OH-)="0.1" mol·L-1 时,由水电离的c(H+) =10-12 /0.1 mol·L-1 =10-11 ;往水中加水解的盐,将促进水的电离。
(2)因为HA为一元酸,所以有0.001molHA电离,则C(H+)="0.001mol÷0.1L=0.01" mol/L,所以pH=-lgC(H+)=2,电离度α=n电离/n总="0.001" mol÷(0.1L×0.2 mol/L) ×100%=5%。
(3)电离平衡常数是衡量弱电解质电离程度强弱的量,所以酸的电离常数越大,则说明该酸酸性越强。所以从右表数据可知,酸性比较:H2CO3 >HCN>HCO3- ,所以根据强酸制弱酸原理,往NaCN溶液中通入少量CO2 发生的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3 。
考点:本题主要考查的是水的离子积常数的影响因素。
本题所属考点:【弱电解质电离平衡】
本题难易程度:【一般】
Time is life. 时间就是生命.