|
|
|
(12分)(1)常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入【弱电解质电离平衡】
2016-12-25 23:10:23
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (12分)(1)常温下,向100 mL 0.0 1 mol·L-1HA溶液中逐滴加入 0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
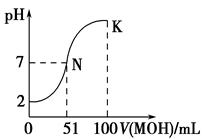
①由图中信息可知HA为________(填“强”或“弱”),理由是___________。
②常温下一定浓度的MA稀溶液的pH=a,则a________7(填“>”、“<”或“=”)。
③请写出K点所对应的溶液中离子浓度的大小关系: 。
(2)已知25 ℃时0.1 mol·L-1醋酸溶液的pH约为3,向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
①为了验证上述哪种解释正确,做如下实验:向0.1 mol·L-1的醋酸溶液中加入少量下列物质中的________(填写编号),然后测定溶液的pH。
| A.固体CH3COOK | B.固体CH3COONH4
| | C.气体NH3 | D.固体NaHCO3
| ②若乙的解释正确,溶液的pH应________(填“增大”“减小”或“不变”)。
填空题 (12分)(1)常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入 0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:

①由图中信息可知HA为________(填“强”或“弱”),理由是___________。
②常温下一定浓度的MA稀溶液的pH=a,则a________7(填“>”、“<”或“=”)。
③请写出K点所对应的溶液中离子浓度的大小关系: & #160; 。
(2)已知25 ℃时0.1 mol·L-1醋酸溶液的pH约为3,向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
①为了验证上述哪种解释正确,做如下实验:向0.1 mol·L-1的醋酸溶液中加入少量下列物质中的________(填写编号),然后测定溶液的pH。
| A.固体CH3COOK | B.固体CH3COONH4
|
| C.气体NH3 | D.固体NaHCO3
|
②若乙的解释正确,溶液的pH应________(填“增大”“减小”或“不变”)。
本题答案:(1)①强 0.01 mol·L-1HA的pH为
本题解析:
试题分析:(1)①因为浓度0.01mol/L,pH=2,故该酸为一元强酸;②V=50ml滴定终点时,pH<7,为强酸弱碱盐,水解为酸性。故该碱为弱碱,M++H2O

MOH+H+,a<7;③K点为MA和MOH的混合溶液,故离子浓度大小关系为c(M+)>c(A-)>c(OH-)>c(H+)。(2)①CH3COONH4溶液中,CH3COO-和NH4+都发生水解,且水解程度相等,CH3COONH4溶液呈中性,将CH3COONH4加入到0.1 mol?L-1醋酸中,如pH增大,说明CH3COO-抑制了醋酸的电离,其它物质的水溶液都呈碱性,不能用于证明;
②CH3COONH4溶液呈中性,加入CH3COONH4,如pH不变,说明是由于水解的原因,如pH变大,是由于醋酸根离子抑制了醋酸的电离,使c(H+)减小,溶液的pH应增大。
考点:考查弱电解质的电离平衡、盐类水解。
本题所属考点:【弱电解质电离平衡】
本题难易程度:【一般】
He is wise that knows when he is well enough. 知足为智者。
 MOH+H+,a<7;③K点为MA和MOH的混合溶液,故离子浓度大小关系为c(M+)>c(A-)>c(OH-)>c(H+)。(2)①CH3COONH4溶液中,CH3COO-和NH4+都发生水解,且水解程度相等,CH3COONH4溶液呈中性,将CH3COONH4加入到0.1 mol?L-1醋酸中,如pH增大,说明CH3COO-抑制了醋酸的电离,其它物质的水溶液都呈碱性,不能用于证明;
MOH+H+,a<7;③K点为MA和MOH的混合溶液,故离子浓度大小关系为c(M+)>c(A-)>c(OH-)>c(H+)。(2)①CH3COONH4溶液中,CH3COO-和NH4+都发生水解,且水解程度相等,CH3COONH4溶液呈中性,将CH3COONH4加入到0.1 mol?L-1醋酸中,如pH增大,说明CH3COO-抑制了醋酸的电离,其它物质的水溶液都呈碱性,不能用于证明;