|
|
|
氨是最重要的化工产品之一。(1)合成氨用的氢气可以甲烷为?【化学平衡】
2016-12-26 15:09:05
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
计算题 氨是最重要的化工产品之一。
(1)合成氨用的氢气可以甲烷为原料制得。有关化学反应的能量变化如下图所示。
反应①②③为_________反应(填“吸热”或“放热”)。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为__________________。
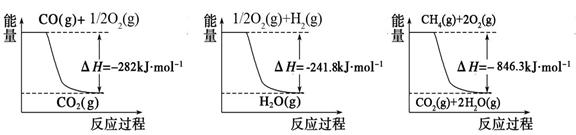
① ② ③
(2)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH 2)2(l)+H2O(g)。 CO(NH 2)2(l)+H2O(g)。
①某温度下,向容积为10L的密闭容器中通入2mol NH3和1molCO2,反应达到平衡时CO2的转化率为50%。该反应的化学平衡常数表达式为K=___________。该温度下平衡常数K的计算结果为____________。
②为进一步提高CO2的平衡转化率,下列措施中能达到目的的是_____________
| A.提高NH3的浓度 | B.增大压强
| | C.及时转移生成的尿素 | D.使用更高效的催化剂
|
计算题 氨是最重要的化工产品之一。
(1)合成氨用的氢气可以甲烷为原料制得。有关化学反应的能量变化如下图所示。
反应①②③为_________反应(填“吸热”或“放热”)。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为__________________。

① ② ③
(2)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)。 CO(NH2)2(l)+H2O(g)。
①某温度下,向容积为10L的密闭容器中通入2mol NH3和1molCO2,反应达到平衡时CO2的转化率为50% 。该反应的化学平衡常数表达式为K=___________。该温度下平衡常数K的计算结果为____________。
②为进一步提高CO2的平衡转化率,下列措施中能达到目的的是_____________
| A.提高NH3的浓度 | B.增大压强
|
| C.及时转移生成的尿素 | D.使用更高效的催化剂
|
本题答案:(16分)(1)放热(2分) CH4
本题解析:
试题分析:(1)读图可知,①②③的反应物能量都高于生成物能量,所以三个反应都是放热反应;已知:①CO(g)+1/2O2(g)=CO2(g) △H1=-282kJ?mol-1,②1/2O2(g)+ H2(g)=H2O(g) △H2=-241.8kJ?mol-1,③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=-846.3kJ?mol-1,观察可知,③—②×3—①能够约去2O2(g)、CO2(g),根据盖斯定律可以得到的热化学方程式为CH4(g)+H2O(g)=CO(g)+3H2 (g) ΔH=+161.1kJ?mol-1;(2)①已知可逆反应中氨气、二氧化碳、水都是气体,而尿素是纯液体,纯液体或固体物质不写入化学平衡常数表达式,由平衡常数定义式可得:K=c(H2O)/[ c2(NH3) ?c(CO2)];根据三行浓度法,则:
2NH3(g)+CO2(g)

CO(NH2)2(l)+H2O(g)
起始浓度/ mol?L-1 0.2 0.1 0
变化浓度/ mol?L-1 0.1 0.05 0.05
平衡浓度/ mol?L-1 0.1 0.05 0.05
K=c(H2O)/[ c2(NH3) ?c(CO2)]=0.05mol?L-1÷(0.1mol?L-1)2÷(0.05mol?L-1)=100L2?mol-2
②提高氨气的浓度,增大一种反应物浓度,平衡右移,则另一种反应物的转化率增大,所以二氧化碳的平衡转化率增大,故A正确;制取尿素是气态物质体积减小的反应,增大压强平衡右移,则反应物的转化率均增大,故B正确;尿素是纯液体,及时转移生成的尿素,不能减小尿素的浓度,则平衡不移动,所以二氧化碳的平衡转化率不变,故C错误;催化剂只能改变反应速率,不能使平衡移动,则反应物的转化率不变,故D错误。
考点:考查反应热、热化学方程式、盖斯定律、化学平衡常数及其计算、外界条件对化学平衡的影响。
本题所属考点:【化学平衡】
本题难易程度:【困难】
Experience is the name everyone gives to their mistakes. 人人都把自己的错误美其名为经验。
 CO(NH2)2(l)+H2O(g)
CO(NH2)2(l)+H2O(g)