微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (8分) CO2是最重要温室气体,如何 降低大气中CO2的含量及有效地开发利用CO2具有重大意义。
(1)科学家用H2和CO2生产甲醇燃料。为探究该反应原理,进行如下实验:某温度下,在容积为2 L的密闭容器中充入1 mol CO2和3.25 mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示。
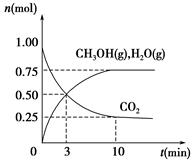
①写出该反应的化学方程式_______________________ 计算从反应开始到3 min时,氢气的平均反应速率v(H2)=____________________。
②下列措施中一定能使CO2的转化率增大的是___________________ 。
A 在原容器中再充入1 mol H2 B 在原容器中再充入1 mol CO2
C 缩小容器的容积 D 使用更有效的催化剂
E.在原容器中充入1 mol He F.将水蒸气从体系中分离出
(2)科学家还利用氢气在一定条件下与二氧化碳反应生成乙醇燃料,其热化学反应方程式为:2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,
CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,
(3)在一定压强下,测得该反应的实验数据如表所示。请根据表中数据回答下列问题。
 温度(K) 温度(K)
 CO2转化率/(%) CO2转化率/(%)
n(H2)/n(CO2)
| 500
| 600
| 700
| 800
|
1.5
| 45
| 33
| 20
| 12
|
2
| 60
| 43
| 28
| 15
|
3
| 83
| 62
| 37
| 22
|
①上述反应的a________0(填“大于”或“小于”)。
②恒温下,向反应体系中加入固体催化剂,则该反应的反应热a值________(填“增大”、“减小”或“不变”)。
③在一定温度下,增大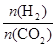 的值,CO2转化率_________,生成乙醇的物质的量________(填“增大”、“减小”、“不变”或“不能确定”)。
的值,CO2转化率_________,生成乙醇的物质的量________(填“增大”、“减小”、“不变”或“不能确定”)。
填空题 (8分) CO2是最重要温室气体,如何降低大气中CO2的含量及有效地开发利用CO2具有重大意义。
(1)科学家用H2和CO2生产甲醇燃料。为探究该反应原理,进行如下实验:某温度下,在容积为2 L的密闭容器中充入1 mol CO2和3.25 mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示。

①写出该反应的化学方程式_______________________ 计算从反应开始到3 min时,氢气的平均反应速率v(H2)=____________________。
②下列措施中一定能使CO2的转化率增大的是___________________ 。
A 在原容器中再充入1 mol H2 B 在原容器中再充入1 mol CO2
C 缩小容器的容积 D 使用更有效的催化剂
E.在原容器中充入1 mol He F.将水蒸气从体系中分离出
(2)科学家还利用氢气在一定条件下与二氧化碳反应生成乙醇燃料,其热化学反应方程式为:2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,
CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,
(3)在一定压强下,测得该反应的实验数据如表所示。请根据表中数据回答下列问题。
 温度(K) 温度(K)
 CO2转化率/(%) CO2转化率/(%)
n(H2)/n(CO2)
| 500
| 600
| 700
| 800
|
1.5
| 45
| 33
| 20
| 来源:91考试网12
|
2
| 60
| 43
| 28
| 15
|
3
| 83
| 62
| 37
| 22
|
①上述反应的a________0(填“大于”或“小于”)。
②恒温下,向反应体系中加入固体催化剂,则该反应的反应热a值________(填“增大”、“减小”或“不变”)。
③在一定温度下,增大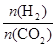 的值,CO2转化率_________,生成乙醇的物质的量________(填“增大”、“减小”、“不变”或“不能确定”)。
的值,CO2转化率_________,生成乙醇的物质的量________(填“增大”、“减小”、“不变”或“不能确定”)。
本题答案:(1) ① CO2 +3H2①根据题意可得该反应的化学方程式是CO2 +3H2 <img onload='if(this.width>600)makesmallpic(this,600,1800);' src=) CH3OH +H2O;V(CO2)=(1.00-0.25)mol÷2L÷3min=0.125mol/(L·min),V(H2)="3" V(CO2)=0.375mol/(L·min), ②A.增大反应物的浓度可以使平衡正向移动,因此可以提高CO2的转化率,正确;B.在原容器中再充入1 mol CO2,平衡正向移动,但是平衡移动消耗量远小于加入量,因此CO2的转化率反而降低,错误;C.缩小容器的容积,即增大压强,平衡向气体体积减小的方向,即向正反应方向移动,故可以提高CO2的转化率,正确;D.使用更有效的催化剂,可以加快反应速率,但是不能时平衡移动,CO2的转化率不变,错误;E.在原容器中充入1 mol He,由于反应混合物中各组分的浓度不变,所以平衡不发生移动,错误;F.将水蒸气从体系中分离出,则减小了生成物的浓度,平衡正向移动,因此可以提高CO2的转化率,正确;(2)①在加入物质的量的比相同时,由于升高温度,CO2转化率降低,说明升高温度,平衡逆向移动,根据平衡移动原理:升高温度,平衡向吸热反应方向移动,逆反应方向是吸热反应,所以该反应的正反应是放热反应,因此上述反应的a<0. ②恒温下,向反应体系中加入固体催化剂由于温度不变,则该反应的反应热a值不变,③在一定温度下,增大
CH3OH +H2O;V(CO2)=(1.00-0.25)mol÷2L÷3min=0.125mol/(L·min),V(H2)="3" V(CO2)=0.375mol/(L·min), ②A.增大反应物的浓度可以使平衡正向移动,因此可以提高CO2的转化率,正确;B.在原容器中再充入1 mol CO2,平衡正向移动,但是平衡移动消耗量远小于加入量,因此CO2的转化率反而降低,错误;C.缩小容器的容积,即增大压强,平衡向气体体积减小的方向,即向正反应方向移动,故可以提高CO2的转化率,正确;D.使用更有效的催化剂,可以加快反应速率,但是不能时平衡移动,CO2的转化率不变,错误;E.在原容器中充入1 mol He,由于反应混合物中各组分的浓度不变,所以平衡不发生移动,错误;F.将水蒸气从体系中分离出,则减小了生成物的浓度,平衡正向移动,因此可以提高CO2的转化率,正确;(2)①在加入物质的量的比相同时,由于升高温度,CO2转化率降低,说明升高温度,平衡逆向移动,根据平衡移动原理:升高温度,平衡向吸热反应方向移动,逆反应方向是吸热反应,所以该反应的正反应是放热反应,因此上述反应的a<0. ②恒温下,向反应体系中加入固体催化剂由于温度不变,则该反应的反应热a值不变,③在一定温度下,增大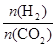 的值,即增大其中一种反应物的浓度,可以使其它物质的转化率增大故CO2转化率增大;由于平衡正向移动,所以生成乙醇的物质的量增大。
的值,即增大其中一种反应物的浓度,可以使其它物质的转化率增大故CO2转化率增大;由于平衡正向移动,所以生成乙醇的物质的量增大。
考点:考查化学反应速率的计算、提高物质转化率的措施、反应热的判断的知识。
本题所属考点:【化学平衡】
本题难易程度:【一般】
Arrogance causes nothing but trouble. It is wiser to ask for advice. 妄自尊大只会带来麻烦.聪明的作法是虚心问人.