微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 (8分)2013年以来全国各地都遭遇“十面霾伏”。其中,二氧化硫、氮氧化物和可吸入颗粒物是雾霾的主要组成成分。综合治理其污染是环境化学当前的重要研究内容。
(1)NO2有较强的氧化性,能将SO2氧化生成SO3,本身被还原为NO,已知下列两反应过程中能量变化如图所示:

则NO2氧化SO2的热化学方程式为 _____________________________ 。
(2)SO2与O2反应时的平衡转化率与温度、压强的关系如图所示。根据图示回答下列问题:
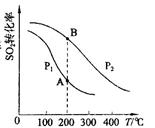
①压强:Pl P2(填“>”、“=”或“<”)。
②平衡常数:A点 B点(填“>”、“=”或“<”)。
③200℃下,将一定量的SO2和O2充人体积为1 L的密闭容器中,经10min后测得容器中各物质的物质的量如下表所示:
气体
| SO2
| O2
| SO3
|
物质的量(mol)
| 1.6
| 1.8
| 0.4
|
10min内该反应的反应速率v(O2)= ;该反应达到化学平衡状态的标志是 。
a.SO2和O2的体积比保持不变 b.体系的压强保持不变
c.混合气体的密度保持不变 d.SO2和SO3物质的量之和保持不变
(3)用NH3催化还原NOx可以消除氮氧化物的污染。
①写出氨气消除NO污染的化学方程式 ___________________________ ;
②若还原产物比氧化产物多0.5mol,则反应转移电子数为 ________ 。
选择题 (8分)2013年以来全国各地都遭遇“十面霾伏”。其中,二氧化硫、氮氧化物和可吸入颗粒物是雾霾的主要组成成分。综合治理其污染是环境化学当前的重要研究内容。
(1)NO2有较强的氧化性,能将SO2氧化生成SO3,本身被还原为NO,已知下列两反应过程中能量变化如图所示:

则NO2氧化SO2的热化学方程式为 _____________________________ 。
(2)SO2与O2反应时的平衡转化率与温度、压强的关系如图所示。根据图示回答下列问题:

①压强:Pl P2(填“>”、“=”或“<”)。
②平衡常数:A点 B点(填“>”、“=”或“<”)。
③200℃下,将一定量的SO2和O2充人体积为1 L的密闭容器中,经10min后测得容器中各物质的物质的量如下表所示:
气体
| SO2
| O2
| SO3
|
物质的量(mol)
| 1.6
| 1.8
| 0.4
|
10min内该反应的反应速率v(O2)= ;该反应达到化学平衡状态的标志是 。
a.SO2和O2的体积比保持不变 b.体系的压强保持不变
c.混合气体的密度保持不变 d.SO2和SO3物质的量之和保持不变
(3)用NH3催化还原NOx可以消除氮氧化物的污染。
①写出氨气消除NO污染的化学方程式 ___________________________ ;
②若还原产物比氧化产物多0.5mol,则反应转移电子数为 ________ 。
本题答案:(1)NO2(g)+SO2(g)根据图像1可得:①2SO2(g)+O2(g)<img onload='if(this.width>600)makesmallpic(this,600,1800);' src=) 2SO3(g) ΔH=-196.6kJ?mol?1,根据图像2可得:②2NO(g)+O2(g)=2NO2(g) ΔH=-113.0kJ?mol?1,根据盖斯定律:①×1/2—②×1/2得NO2(g)+SO2(g)
2SO3(g) ΔH=-196.6kJ?mol?1,根据图像2可得:②2NO(g)+O2(g)=2NO2(g) ΔH=-113.0kJ?mol?1,根据盖斯定律:①×1/2—②×1/2得NO2(g)+SO2(g) SO3(g)+NO(g) ΔH=-41.8kJ?mol?1;(2)①SO2与O2反应的反应为气体物质的量减小的反应,增大压强,平衡正向移动,二氧化硫的转化率增大;由图像可知,压强为P2时二氧化硫平衡转化率较大,即压强:Pl <P2;②由图像可知,A、B两点温度相同,平衡常数的影响因素为温度,故平衡常数:A点=B点;③根据公式v=△n/V△t 代入题给数据计算v (SO3)=0.4mol/1L×10min=0.04mol/(L·min),根据速率之比等于化学计量数之比得10min内该反应的反应速率v(O2)= 0.02mol/(L·min);根据“变量不变,已达平衡”判断;a.分析题给数据知,随着反应的进行SO2和O2的体积比不断变化,当其保持不变时已达平衡,正确;b.随着反应的进行容器内气体的物质的量不断减小,体系的压强不断减小,当其保持不变时已达平衡,正确;c.等容条件下混合气体的密度为恒量,不能作平衡标志,错误;d.SO2和SO3物质的量之和始终为2mol,不能作平衡标志,错误,选ab。(3)①氨气与NO反应生成氮气和水,利用化合价升降法配平,化学方程式为4NH3+6NO=5N2+6H2O;②根据上述反应知,该反应转移的电子数为12e-,还原产物比氧化产物多1mol,若还原产物比氧化产物多0.5mol,则反应转移电子数为6mol或6×6.02×1023。
SO3(g)+NO(g) ΔH=-41.8kJ?mol?1;(2)①SO2与O2反应的反应为气体物质的量减小的反应,增大压强,平衡正向移动,二氧化硫的转化率增大;由图像可知,压强为P2时二氧化硫平衡转化率较大,即压强:Pl <P2;②由图像可知,A、B两点温度相同,平衡常数的影响因素为温度,故平衡常数:A点=B点;③根据公式v=△n/V△t 代入题给数据计算v (SO3)=0.4mol/1L×10min=0.04mol/(L·min),根据速率之比等于化学计量数之比得10min内该反应的反应速率v(O2)= 0.02mol/(L·min);根据“变量不变,已达平衡”判断;a.分析题给数据知,随着反应的进行SO2和O2的体积比不断变化,当其保持不变时已达平衡,正确;b.随着反应的进行容器内气体的物质的量不断减小,体系的压强不断减小,当其保持不变时已达平衡,正确;c.等容条件下混合气体的密度为恒量,不能作平衡标志,错误;d.SO2和SO3物质的量之和始终为2mol,不能作平衡标志,错误,选ab。(3)①氨气与NO反应生成氮气和水,利用化合价升降法配平,化学方程式为4NH3+6NO=5N2+6H2O;②根据上述反应知,该反应转移的电子数为12e-,还原产物比氧化产物多1mol,若还原产物比氧化产物多0.5mol,则反应转移电子数为6mol或6×6.02×1023。
考点:考查热化学方程式的书写、盖斯定律,化学反应速率和化学平衡,氧化还原方程式的书写和计算。
本题所属考点:【化学平衡】
本题难易程度:【一般】
What is worth doing is worth doing well. 一件事如果值得做,就值得做好.