微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (12分)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)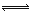 NaNO3(s)+ClNO(g) K1 ?H1 < 0 (I)
NaNO3(s)+ClNO(g) K1 ?H1 < 0 (I)
2NO(g)+Cl2(g)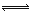 2ClNO(g) K2 ?H2 < 0 (II)
2ClNO(g) K2 ?H2 < 0 (II)
(1)4NO2(g)+2NaCl( s)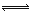 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内 (ClNO)=7.5×10-3mol?L-1?min-1,则平衡后n(Cl2)= mol,NO的转化率α1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率α2 α1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”)。若要使K2减小,可采用的措施是 。
(ClNO)=7.5×10-3mol?L-1?min-1,则平衡后n(Cl2)= mol,NO的转化率α1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率α2 α1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”)。若要使K2减小,可采用的措施是 。
填空题 (12分)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)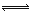 NaNO3(s)+ClNO(g) K1 ?H1 < 0 (I)
NaNO3(s)+ClNO(g) K1 ?H1 < 0 (I)
2NO(g)+Cl2(g)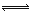 2ClNO(g) K2 ?H2 < 0 (II)
2ClNO(g) K2 ?H2 < 0 (II)
(1)4NO2(g)+2NaCl(s)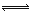 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内 (ClNO)=7.5×10-3mol?L-1?min-1,则平衡后n(Cl2)= mol,NO的转化率α1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率α2 α1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”)。若要使K2减小,可 采用的措施是 。
(ClNO)=7.5×10-3mol?L-1?min-1,则平衡后n(Cl2)= mol,NO的转化率α1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率α2 α1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”)。若要使K2减小,可 采用的措施是 。
本题答案:(1)2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g),△H1<0 (Ⅰ),平衡常数K1=<img onload='if(this.width>600)makesmallpic(this,600,1800);' src=) ;②2NO(g)+Cl2(g)?2ClNO(g),△H2<0 (Ⅱ),平衡常数K2 =
;②2NO(g)+Cl2(g)?2ClNO(g),△H2<0 (Ⅱ),平衡常数K2 = ③4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=
③4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=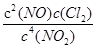 ,故平衡常数K=
,故平衡常数K=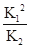 ;(2)在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(Ⅱ)达到平衡,测得10min内v(ClNO)=7.5×10-3mol?L-1?min-1,物质的量为7.5×10-3mol?L-1?min-1×10min×2L=0.15mol,
;(2)在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(Ⅱ)达到平衡,测得10min内v(ClNO)=7.5×10-3mol?L-1?min-1,物质的量为7.5×10-3mol?L-1?min-1×10min×2L=0.15mol,
2NO(g)+Cl2(g)?2ClNO(g),
起始量(mol) 0.2 0.1 0
变化量(mol) 0.15 0.075 0.15
平衡量(mol) 0.05 0.025 0.15
则平衡后n(Cl2)=0.025mol,NO的转化率α1= ×100%=75%;其他条件保持不变,反应(Ⅱ)在恒压条件下进行,随反应进行,气体体积减小,为保持恒压所以容器体积减小,压强比恒容容器大,平衡正向进行,平衡时NO的转化率α2增大;平衡常数随温度变化,不随浓度、压强变化,若要使K2减小,平衡逆向进行,反应是放热反应,依据平衡移动原理应升高温度,平衡逆向进行;故答案为:0.025;75%;>;不变;升高温度.
×100%=75%;其他条件保持不变,反应(Ⅱ)在恒压条件下进行,随反应进行,气体体积减小,为保持恒压所以容器体积减小,压强比恒容容器大,平衡正向进行,平衡时NO的转化率α2增大;平衡常数随温度变化,不随浓度、压强变化,若要使K2减小,平衡逆向进行,反应是放热反应,依据平衡移动原理应升高温度,平衡逆向进行;故答案为:0.025;75%;>;不变;升高温度.
考点:化学平衡的影响因素
本题所属考点:【化学平衡】
本题难易程度:【一般】
Brevity is the soul of wit. 言以简为贵.