微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (11分)化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成lmol AX5,放出热量123.8 kJ。该反应的热化学方程式为 &# 160; 。
(2)反应AX3(g)+X2(g) AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
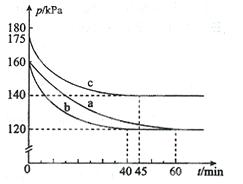
①列式计算实验a从反应开始至达到平衡时的反应速率v(AX5)= 。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为 (填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b 、c 。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为 。
填空题 (11分)化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成lmol AX5,放出热量123.8 kJ。该反应的热化学方程式为 。
(2)反应AX3(g)+X2(g) AX5(g)在容积为 10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为 10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。

①列式计算实验a从反应开始至达到平衡时的反应速率v(AX5)= 。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为 (填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b 、c 。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为 。
本题答案:(1)AX3(l)+X2(g) = AX5(s)
本题解析:
试题分析:(1)根据题给信息,室温时AX3为液态,AX5为固态。室温时AX3与气体X2反应生成lmol AX5,放出热量123.8 kJ。该反应的热化学方程式为AX3(l)+X2(g) = AX5(s) ΔH=-123.8KJ·mol-1;(2)①根据题给信息和图像知,开始时no =" 0.4" mol,总压强为160 kPa,平衡时总压强为120 kPa,根据阿伏伽德罗定律则平衡时气体的总物质的量为0.30mol,利用三行式分析,设转化的AX5的物质的量为x
AX3(g) + X2(g)  AX5(g)
AX5(g)
起始量(mol) 0.20 0.20 0
平衡量(mol) 0.20 -x 0.20 -x x
(0.20-x)+(0.20-x)+x = 0.30,解得x = 0.10
则v(AX5)=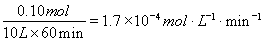 ;
;
②从图中观察平衡的时间(tb<tc<ta),判断反应速率的快慢为b>c>a;b组的反应速率加快,但平衡点没有改变说明是加人了催化剂;c组的反应速率加快,但平衡点向逆反应方向移动(或反应容器的容积和起始物质的量未改变,但起始总压强增大)说明是温度升高。③用三行式分析:
AX3(g) + X2(g)  AX5(g)
AX5(g)
起始量(mol) 0.20 0.20 0
变化量(mol) 0.20α 0.20α 0.20α
平衡量(mol) 0.20 -0.20α 0.20 -0.20α 0.20α
据题意有p0/p=0.4mol/(0.4—0.2?)mol,化简得α=2(1-p/p0)。
考点:考查热化学方程式的书写,化学反应速率的计算,化学平衡移动原理的应用,转化率的计算等。
本题所属考点:【化学平衡】
本题难易程度:【困难】
Time is life. 时间就是生命.