微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (14分)恒容体系,发生如下反应2A(g)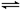 B(g)+xC(?) △H,起始时B、C物质的量浓度为0,A的物质的量浓度随时间变化如下图(某课外活动小组一共进行了如图所示的三个实验,其中T1、T2表示不同的反应温度):
B(g)+xC(?) △H,起始时B、C物质的量浓度为0,A的物质的量浓度随时间变化如下图(某课外活动小组一共进行了如图所示的三个实验,其中T1、T2表示不同的反应温度):
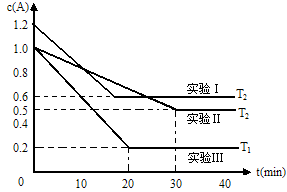
(1)在实验Ⅲ中,0~20min的时间内,v(B)= 。
(2)根据以上实验事实,完成以下填空:x= ,生成物C的状态为 ,反应热
△H 0(填“>”、“=”或者“<”)。
(3)在实验Ⅱ中,当化学反应进行到35min时,下列关于反应体系中的有关说法,正确的是 。
a.单位时间内生成n mol B的同时生成2n mol A
b.单位时间内生成n mol C的同时消耗2n mol A
c.用A、B、C表示的反应速率的比为2:1:2
d.混合气体中反应物A与生成物B的体积分数之比为2:1
e.混合气体中B与C的物质的量相等
(4)该反应的化学平衡常数表达式K= & #160; ,在T2℃时K的数值为 。
(5)T1℃时,保持容器的体积不变,若充入amolA、bmolB、cmolC,达到平衡时C的体积分数为0.4,则a、b、c的取值可以是 。
a.a=2、b=1、c=2
b.a=0.5、b=1.7、c=1.7
c.a=1、b=1、c=1
d.a=x、b=c=2x(x>0)
e.b=c、a为大于0的任意值
填空题 (14分)恒容体系,发生如下反应2A(g)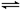 B(g)+xC(?) △H,起始时B、C物质的量浓度为0,A的物质的量浓度随时间变化如下图(某课外活动小组一共进行了如图所示的三个实验,其中T1、T2表示不同的反应温度):
B(g)+xC(?) △H,起始时B、C物质的量浓度为0,A的物质的量浓度随时间变化如下图(某课外活动小组一共进行了如图所示的三个实验,其中T1、T2表示不同的反应温度):

(1)在实验Ⅲ中,0~20min的时间内,v(B)= 。
(2)根据以上实验事实,完成以下填空:x= ,生成物C的状态为 ,反应热
△H 0(填“>”、“=”或者“<”)。
(3)在实验Ⅱ中,当化学反应进行到35min时,下列关于反应体系中的有关说法,正确的是 。
a.单位时间内生成n mol B的同时生成2n mol A
b.单位时间内生成n mol C的同时消耗2n mol A
c.用A、B、C表示的反应速率的比为2:1:2
d.混合气体中反应物A与生成物B的体积分数之比为2:1
e.混合气体中B与C的物质的量相等
(4)该反应的化学平衡常数表达式K= ,在T2℃时K的数值为 。
(5)T1℃时,保持容器的体积不变,若充入amolA、bmolB、cmolC,达到平衡时C的体积分数为0.4,则a、b、c的取值可以是 。
a.a=2、b=1、c=2
b.a=0.5、b=1.7、c=1.7
c.a=1、b=1、c=1
d.a=x、b=c=2x(x>0)
e.b=c、a为大于0的任意值
本题答案:(1)0.02mol/(L·min) (2分) &
本题解析:
试题分析:(1)根据图可知20min内,A的浓度变化为1mol/L-0.2mol/L=0.8mol/L,则v(A)=0.8mol/L÷20min=0.04mol/(L·min)。化学反应速率之比等于化学计量数之比,所以v(B)=1/2v(A)=1/2×0.04mol/(L·min)=0.02mol/(L·min);
(2)在实验Ⅰ、Ⅱ中温度相同,A的起始浓度不同。实验Ⅰ中A的转化率为(0.6molL÷1.2mol/L)×100%=50%,实验Ⅱ中A的转化率为(0.5molL÷1mol/L)×100%=50%,即平衡时A的转化率相同,二者为等效平衡,故反应前后气体的体积不变。由方程式可知,A的化学计量数等于B与C的化学计量数之和,C为气态,即1+x=2,解得x=1;比较实验Ⅱ、Ⅲ可知,A的起始浓度相同、温度不同,温度越高,反应速率越快,最先到达平衡,故温度T1>T2。由图可知温度越高A的转化率越大,温度升高平衡向正反应移动,升高温度平衡向吸热反应移动,则正反应为吸热反应,即△H>0;
(3)根据图像可知实验Ⅱ中,当化学反应进行到35min时,反应以达平衡状态,则a、根据方程式可知单位时间内生成n mol B的同时生成2n mol A,说明正逆反应速率相等,反应达平衡状态,a正确;b、单位时间内生成n mol C的同时消耗2n mol A,都表示正反应速率,在任何情况下均成立,b正确;c、速率之比等于化学计量数之比,用A、B、C表示的反应速率的比应该为2:1:1,c错误;d、平衡时A的浓度为0.5mol/L,A的浓度变化为1.0mol/L-0.5mol/L=0.5mol/L。由方程式可知平衡时B的浓度为0.25mol/L,则混合气体中反应物A与生成物B的体积分数之比为2:1,d正确;e、起始时B、C物质的量浓度为0,则根据化学方程式可知混合气体中B与C的物质的量之比始终等于化学计量数之比为1:1,e正确,答案选abde;
(4)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则可逆反应2A(g) B(g)+C(g)的平衡常数k=[c(B)·c(C)]/[c2(A)];根据图像可知,在实验Ⅱ中平衡时A的浓度为0.5mol/L,A的浓度变化为1mol/L-0.5mol/L=0.5mol/L,由方程式可知平衡时B的浓度为1/2×0.5mol/L=0.25mol/L,C的浓度为1/2×0.5mol/L=0.25mol/L,则温度下平衡常数k=
B(g)+C(g)的平衡常数k=[c(B)·c(C)]/[c2(A)];根据图像可知,在实验Ⅱ中平衡时A的浓度为0.5mol/L,A的浓度变化为1mol/L-0.5mol/L=0.5mol/L,由方程式可知平衡时B的浓度为1/2×0.5mol/L=0.25mol/L,C的浓度为1/2×0.5mol/L=0.25mol/L,则温度下平衡常数k=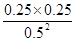 =0.25;
=0.25;
(5)根据图像可知,T1℃达平衡时A的浓度为0.2mol/L,A的浓度变化为1mol/L-0.2mol/L=0.8mol/L。由方程式可知平衡时C的浓度为1/2×0.8mol/L=0.4mol/L,C体积分数为0.4mol/L÷1mol/L=0.4;T1℃时,保持容器的体积不变,若充入amolA、bmolB、cmolC,达到平衡时C的体积分数为0.4,说明为等效平衡。由于该反应前后气体的体积不变,因此只要满足B、C的物质的量为1:1即可,与A的量无关。则a、若为a=2、b=1、c=2,不能满足B、C的物质的量为1:1,a错误;b、a=0.5、b=1.7、c=1.7,满足B、C的物质的量为1:1,b正确;c、a=1、b=1、c=1,满足B、C的物质的量为1:1,c正确;d、a=x、b=c=2x(x>0),满足B、C的物质的量为1:1,d正确;e、b=c、a为大于0的任意,满足B、C的物质的量为1:1,d正确,答案选bcde。
考点:考查反应速率计算、化学平衡状态特征、平衡常数、化学平衡计算、等效平衡、化学平衡图象等
本题所属考点:【化学平衡】
本题难易程度:【困难】
For a man to become a poet he must be in love, or miserable. 一个人要恋爱或潦倒才可成为诗人。