微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (8分)下图装置中,A是由导热材料制成的密闭容器,B是耐化学腐蚀且易于传热的透明气球,关闭K2,将等量1mol的NO2通过K1、K3分别充A、B中,反应起始时,A、B的体积相同均为a L。已知:2NO2(g) 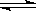 N2O4(g)
N2O4(g) 

(1)B中可通过 判断可逆反应2NO2(g) 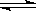 N2O4(g)已经达到平衡。
N2O4(g)已经达到平衡。
(2)若平衡后向A中再充入0.5 mol N2O4,则重新到达平衡后,平衡混合气中NO2的体积分数 (填“变小” 、“变大”或“不变”)。
(3)若A中到达平衡所需时间为t s,达到平衡后容器内压强为起始压强的0.8倍,则平均反应速率v(NO2)= 。
(4)若打开K2,平衡后B的体积缩至0.4a L,则打开K2前,B的体积为 。
填空题 (8分)下图装置中,A是由导热材料制成的密闭容器,B是耐化学腐蚀且易于传热的透明气球,关闭K2,将等量1mol的NO2通过K1、K3分别充A、B中,反应起始时,A、B的体积相同均为a L。已知:2NO2(g) 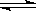 N2O4(g)
N2O4(g) 

(1)B中可通过 判断可逆反应2NO2(g) 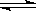 N2O4(g)已经达到平衡。
N2O4(g)已经达到平衡。
(2)若平衡后向A中再充入0.5 mol N2O4,则重新到达平衡后,平衡混合气中NO2的体积分数 (填“变小”、“变大”或“不变”)。
(3)若A中到达平衡所需时间为t s,达到平衡后容器内压强为起始压强的0.8倍,则平均反应速率v(NO2)= 。
(4)若打开K2,平衡后B的体积缩至0.4a L,则打开K2前,B的体积为 。
本题答案:(1)颜色变化 (2)变小 (3) 0.4/at
本题解析:
试题分析:(1) NO2是红棕色气体,N2O4是无色气体,故通过颜色是否变化来判断反应是否达到平衡。 (2) 充入0.5 mol N2O4,相当于增大压强,平衡向正向移动,NO2体积分数变小。 (3) 设NO2转化了x,
2NO2(g) 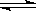 N2O4(g)
N2O4(g)
起始(mol) 1 0
变化(mol) x 0.5x
平衡(mol) 1-x 0.5x 平衡后容器内压强为起始压强的0.8倍则有:(1-x+0.5x)/1="0.8" 得:x="0.4mol" ,v(NO2) =0.4来源:91考试网 91EXAm.orgmol÷aL ÷ts=" 0.4/at" mol/(L·s)。 (4) A是由导热的密闭容器,B是易于传热的透明气球,若打开K2,A、B就联系在一起,那么这个体系就是一个恒温恒压的平衡,此时反应体系中中反应物的总物质的量为B中的2倍,打开K2前,B的体积为(a+0.4a)/2=0.7a
考点:化学平衡的判断和计算、等效平衡。
本题所属考点:【化学平衡】
本题难易程度:【困难】
Good wine needs no bush. 酒好无需挂幌子。