微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (11分)天然气是一种重要的化工原料。
I.2014年5月,我国科学家成功实现了甲烷在无氧条件下选择活化,一步高效生产乙烯、苯、氢气等高值化学品。
(1)苯的二氯代物的同分异构体有 种。
(2)乙烯通入溴的四氯化碳溶液中,反应的化学方程式为 。
(3)已知甲烷、乙烯、氢气燃烧的热化学方程式分别如下:
①CH4(g) 来源:www.91exam.org+2O2(g) ="==" CO2(g) +2H2O ( l ) ΔH=" -" 890.3 kJ·mol-1
②C2H4(g)+3O2(g) ="==" 2CO2(g) +2H2O ( l ) ΔH=" -" 1 306.4 kJ·mol-1
③2H2 (g)+O2 (g) ="==" 2H2O ( l ) ΔH=" -" 571.6 kJ·mol-1
则2CH4(g) ===C2H4(g) +2H2 (g) 的ΔH= 。
Ⅱ.甲烷的传统转化利用,第一步制取合成气(CO、H2),第二步用合成气制取甲醇(CH3OH)、二甲醚(CH3OCH3)等。
(4)某温度下,将1mol CH4和1 mol H2O(g)充入容积为0.5 L的密闭容器中,发生如下反应:
CH4(g) +H2O(g) CO(g) +3H2 (g) ΔH=" +206.4" kJ·mol-1
CO(g) +3H2 (g) ΔH=" +206.4" kJ·mol-1
当反应达到平衡时,测得其平衡常数K=27。
①CH4的平衡转化率 = 。
②如果其它条件不变,升高温度,CH4的平衡常数 (填“增大”、“减小”或“不变”)。
(5)在一定条件下,合成气发生如下两个主要反应:
CO(g)+2H2(g)="==" CH3OH(g) ΔH= -90.1kJ·mol-1
2CO(g)+4H2(g)="==" CH3OCH3(g) + H2O(g) ΔH= -204.7kJ·mol-1。
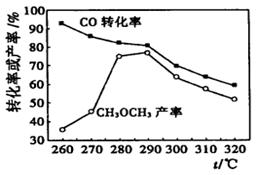
仅根据下图,选择该条件下制取甲醇的最佳温度为 。
填空题 (11分)天然气是一种重要的化工原料。
I.2014年5月,我国科学家成功 实现了甲烷在无氧条件下选择活化,一步高效生产乙烯、苯、氢气等高值化学品。
(1)苯的二氯代物的同分异构体有 种。
(2)乙烯通入溴的四氯化碳溶液中,反应的化学方程式为 。
(3)已知甲烷、乙烯、氢气燃烧的热化学方程式分别如下:
①CH4(g) +2O2(g) ="==" CO2(g) +2H2O ( l ) ΔH=" -" 890.3 kJ·mol-1
②C2H4(g)+3O2(g) ="==" 2CO2(g) +2H2O ( l ) ΔH=" -" 1 306.4 kJ·mol-1
③2H2 (g)+O2 (g) ="==" 2H2O ( l ) ΔH=" -" 571.6 kJ·mol-1
则2CH4(g) ===C2H4(g) +2H2 (g) 的ΔH= 。
Ⅱ.甲烷的传统转化利用,第一步制取合成气(CO、H2),第二步用合成气制取甲醇(CH3OH)、二甲醚(CH3OCH3)等。
(4)某温度下,将1mol CH4和1 mol H2O(g)充入容积为0.5 L的密闭容器中,发生如下反应:
CH4(g) +H2O(g) CO(g) +3H2 (g) ΔH=" +206.4" kJ·mol-1
CO(g) +3H2 (g) ΔH=" +206.4" kJ·mol-1
当反应达到平衡时,测得其平衡常数K=27。
①CH4的平衡转化率 = 。
②如果其它条件不变,升高温度,CH4的平衡常数 (填“增大”、“减小”或“不变”)。
(5)在一定条件下,合成气发生如下两个主要反应:
CO(g)+2H2(g)="==" CH3OH(g) ΔH= -90.1kJ·mol-1
2CO(g)+4H2(g)="==" CH3OCH3(g) + H2O(g) ΔH= -204.7kJ·mol-1。
仅根据下图,选择该条件下制取甲醇的最佳温度为 。

本题答案:(1)3(2分);(2)CH2=CH2+Br2![]() 本题解析:
本题解析:
试题分析:(1) 苯的二氯代物的同分异构体有邻位、间位、对位三种不同的位置;(2)乙烯通入溴的四氯化碳溶液中,发生加成反应,产生1,2-二氯乙烷,反应的化学方程式为CH2=CH2+Br2 CH2BrCH2Br;(3)①×2-②-③,整理可得:2CH4(g) =C2H4(g) +2H2 (g) 的 ΔH=+97.4KJ/mol;(4) ①在反应开始时,各种物质的浓度是:c(CH4)= c(H2O)=2mol/L;c(CO)=c(H2 )=0,假设在反应过程中,Δc(CH4) =x,则平衡时各种物质的浓度分别是:c(CH4)= c(H2O)=(2-x)mol/L,c(CO)=xmol/L;c(H2 )=3xmol/L,则根据平衡常数的定义可得:
CH2BrCH2Br;(3)①×2-②-③,整理可得:2CH4(g) =C2H4(g) +2H2 (g) 的 ΔH=+97.4KJ/mol;(4) ①在反应开始时,各种物质的浓度是:c(CH4)= c(H2O)=2mol/L;c(CO)=c(H2 )=0,假设在反应过程中,Δc(CH4) =x,则平衡时各种物质的浓度分别是:c(CH4)= c(H2O)=(2-x)mol/L,c(CO)=xmol/L;c(H2 )=3xmol/L,则根据平衡常数的定义可得: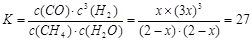 ,解得x=1mol/L,所以CH4的平衡转化率=(1mol/L÷2mol/L)×100%=50%;②由于该反应的正反应是吸热反应,所以如果其它条件不变,升高温度,平衡向吸热的正反应方向移动,所以CH4的平衡常数增大;(5)根据图示可知在低温时CO的转化率较高,而且温度越高,CH3OCH3的产率逐渐升高,这对于甲醇的生产不利,因此应该控制反应温度在260℃。
,解得x=1mol/L,所以CH4的平衡转化率=(1mol/L÷2mol/L)×100%=50%;②由于该反应的正反应是吸热反应,所以如果其它条件不变,升高温度,平衡向吸热的正反应方向移动,所以CH4的平衡常数增大;(5)根据图示可知在低温时CO的转化率较高,而且温度越高,CH3OCH3的产率逐渐升高,这对于甲醇的生产不利,因此应该控制反应温度在260℃。
考点:考查物质的反应类型、同分异构体的种类的判断、反应条件的控制、热化学方程式和化学反应方程式的书写、物质的转化率的计算温度对化学平衡移动的影响的知识。
本题所属考点:【化学平衡】
本题难易程度:【困难】
Fame is the chastisement of merit and the punishment of talent. 盛名殊誉乃德才之忌.