微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
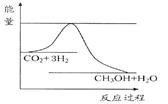
(1)关于该反应的下列说法中,其△H 0。(填“大于”、“小于”或“等于”), 且在 (填“较高”或“较低”)温度下有利于该反应自发进行。
(2)该反应平衡常数K的表达式为 。
(3)温度降低,平衡常数K (填“增大”、“不变”或“减小”)。
(4)若为两个容积相同的密闭容器,现向甲容器中充入1 mol CO2(g)和3 molH2(g),乙容器中充入1mol CH3OH(g)和1 mol H2O(g),在相同的温度下进行反应,达到平衡时,甲容器内n(CH3OH) (填“大于”“小于”或“等于”)乙容器内n(CH3OH)。
(5)已知:CO(g)+2H2(g) = CH3OH (g) △H=" -116" kJ?mol-1;CO(g)+1/2O2(g)=CO2(g) △H="-283" kJ?mol-1;H2 (g)+1/2O2(g)=H2O(g) △H="-242" kJ?mol-1 ,写出CH3OH燃烧生成CO2和水蒸气的热化学方程式______________________________________。
(6)以甲醇和氧气为燃料,氢氧化钾溶液为电解质溶液构成电池。
①负极的电极反应式为 。
②若以石墨为电极,电解硫酸铜溶液,写出电解的总反应方程式 。若以此燃料电池电解200 mL 0.8mol/L的硫酸铜溶液,当消耗1.6甲醇时,在阴极会析出 g铜。
填空题 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。

(1)关于该反应的下列说法中,其△H 0。(填“大于”、“小于”或“等于”), 且在 (填“较高”或“较低”)温度下有利于该反应自发进行。
(2)该反应平衡常数K的表达式为 。
(3)温度降低,平衡常数K (填“增大”、“不变”或“减小”)。
(4)若为两个容积相同的密闭容器,现向甲容器中充入1 mol CO2(g)和3 molH2(g),乙容器中充入1mol CH3OH(g)和1 mol H2O(g),在相同的温度下进行反应,达到平衡时,甲容器内n(CH3OH) (填“大于”“小于”或“等于”)乙容器内n(CH3OH)。
(5)已知:CO(g)+2H2(g) = CH3OH (g) △H=" -116" kJ?mol-1;CO(g)+1/2O2(g)=CO2(g) △H="-283" kJ?mol-1;H2 (g)+1/2O2(g)=H2O(g) △H="-242" kJ?mol-1 ,写出CH3OH燃烧生成CO2和水蒸气的热化学方程式______________________________________。
(6)以甲醇和氧气为燃料,氢氧化钾溶液为电解质溶液构成电池。
①负极的电极反应式为 。
②若以石墨为电极,电解硫酸铜溶液,写出电解的总反应方程式 。若以此燃料电池电解200 mL 0.8mol/L的硫酸铜溶液,当消耗1.6甲醇时,在阴极会析出 g铜。
本题答案:(1)小于 较低 (2)K=c(CH3O
本题解析:
试题分析:(1)根据该反应的能量关系图知,反应物的总能量大于生成物的总能量,该反应为放热反应,△H小于0;该反应正向为气体物质的量减小的放热反应,ΔH<0,ΔS<0;根据化学反应方向的判据ΔH —TΔS,若该反应自发进行,则有ΔH —TΔS<0,在较低温度下有利于该反应自发进行;(2)根据题给反应方程式知,该反应平衡常数K的表达式为K=c(CH3OH)·c(H2O)/[c(CO2)·c3(H2)];(3)该反应为放热反应,温度降低,平衡正向移动,平衡常数K增大;(4)根据等效平衡知识知,在一定条件下的可逆反应,无论反应从正向开始,还是从逆向开始,只要最初加入的物质的量相当,就会达到同一平衡状态,则达到平衡时,甲容器内n(CH3OH)等于乙容器内n(CH3OH);(5)已知:①CO(g)+2H2(g) = CH3OH (g) △H=" -116" kJ?mol-1;②CO(g)+1/2O2(g)=CO2(g) △H="-283" kJ?mol-1;③H2 (g)+1/2O2(g)=H2O(g) △H="-242" kJ?mol-1 ,根据盖斯定律知,②×2+③×4—①×2,得CH3OH燃烧生成CO2和水蒸气的热化学方程式为2CH3OH(g)+3 O2(g)=2CO2(g)+4H2O(g) ΔH="-1302kJ/mol" ;(6)以甲醇和氧气为燃料,氢氧化钾溶液为电解质溶液构成电池。①原电池负极发生氧化反应,甲醇在负极放电,碱性条件下生成碳酸根与水,电极反应式为:CH3OH+8OH- - 6e- =CO32- + 6H2O,②若以石墨为电极,电解硫酸铜溶液,电解的总反应方程式2Cu2++2H2O=2Cu+O2↑+4H+,若以此燃料电池电解200 mL 0.8mol/L的硫酸铜溶液,1.6g甲醇的物质的量为0.05mol,根据电极反应式知,转移的电子为0.3mol,根据电子守恒知,在阴极会析出铜0.15mol,质量为9.6g。
考点:考查化学反应与能量变化、盖斯定律、燃料电池和电化学计算。
本题所属考点:【热化学方程式】
本题难易程度:【困难】
Fair and softly goes far. 谦和者致远。