微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (共16分)近年来对CO2的有效控制及其高效利用的研究正引起全球广泛关注。据中国化工报报道,美国科学家发现了一种新的可将CO2转化为甲醇的高活性催化体系,比目前工业使用的常见催化剂快近90倍。由CO2制备甲醇过程可能涉及反应如下:
反应Ⅰ: CO2(g)+3H2(g) CH3OH(g) +H2O(g) △H 1=-49.58 kJ?mol-1
CH3OH(g) +H2O(g) △H 1=-49.58 kJ?mol-1
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) △H 2
CO(g)+H2O(g) △H 2
反应Ⅲ: CO(g)+2 H2(g) CH3OH(g) △H 3=-90.77 kJ?mol-1
CH3OH(g) △H 3=-90.77 kJ?mol-1
回答下列问题:
(1)反应Ⅱ的△H 2= ,反应Ⅲ自发进行条件是 (填“较低温”、“较高温”或“任何温度”)。
(2)在一定条件下2L恒容密闭容器中充入一定量的H2和CO2仅发生反应Ⅰ,实验测得在不同反应物起始投入量下,反应体系中CO2的平衡转化率与温度的关系曲线,如下图所示。

①据图可知,若要使CO2的平衡转化率大于40%,以下条件中最合适的是 ;
A.n(H2)=3mol,n(CO2)=1.5mol; 650K
B.n(H2)=3mol,n(CO2)=1.7mol;550K
C.n(H2)=3mol,n(CO2)=1.9mol; 650K
D.n(H2)=3mol,n(CO2)=2.5mol;550K
②在温度为500K的条件下,充入3mol H2和1.5mol CO2,该反应10min时达到平衡:
a.用H2表示该反应的速率为 ;
b.该温度下,反应I的平衡常数K= ;
c.在此条件下,系统中CH3OH的浓度随反应时间的变化趋势如图所示,当反应时间达到3min时,迅速将体系温度升至600K,请在图中画出3~10min内容器中CH3OH浓度的变化趋势曲线 :

(3)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应I、Ⅱ、
Ⅲ),测得了不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图所示,请回答问题:

①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是 (选填编号)。
A.改用高效催化剂
B.升高温度
C.缩小容器体积
D.分离出甲醇
E.增加CO2的浓度
②据图可知当温度高于260℃后,CO的浓度随着温度的升高而 (填“增大”、“减小”、“不变”或“无法判断”),其原因是 。
填空题 (共16分)近年来对CO2的有效控制及其高效利用的研究正引起全球广泛关注。据中国化工报报道,美国科学家发现了一种新的可将CO2转化为甲醇的高活性催化体系,比目前工业使用的常见催化剂快近90倍。由CO2制备甲醇过程可能涉及反应如下:
反应Ⅰ: CO2(g)+3H2(g) CH3OH(g) +H2O(g) △H 1=-49.58 kJ?mol-1
CH3OH(g) +H2O(g) △H 1=-49.58 kJ?mol-1
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) △H 2
CO(g)+H2O(g) △H 2
反应Ⅲ: CO(g)+2 H2(g) CH3OH(g) △H 3=-90.77 kJ?mol-1
CH3OH(g) △H 3=-90.77 kJ?mol-1
回答下列问题 :
(1)反应Ⅱ的△H 2= ,反应Ⅲ自发进行条件是 (填“较低温”、“较高温”或“任何温度”)。
(2)在一定条件下2L恒容密闭容器中充入一定量的H2和CO2仅发生反应Ⅰ,实验测得在不同反应物起始投入量下,反应体系中CO2的平衡转化率与温度的关系曲线,如下图所示。

①据图可知,若要使CO2的平衡转化率大于40%,以下条件中最合适的是 ;
A.n(H2)=3mol,n(CO2)=1.5mol; 650K
B.n(H2)=3mol,n(CO2)=1.7mol;550K
C.n(H2)=3mol,n(CO2)=1.9mol; 650K
D.n(H2)=3mol,n(CO2)=2.5mol;550K
②在温度为500K的条件下,充入3mol H2和1.5mol CO2,该反应10min时达到平衡:
a.用H2表示该反应的速率为 ;
b.该温度下,反应I的平衡常数K= ;
c.在此条件下,系统中CH3OH的浓度随反应时间的变化趋势如图所示,当反应时间达到3min时,迅速将体系温度升至600K,请在图中画出3~10min内容器中CH3OH浓度的变化趋势曲线:

(3)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应I、Ⅱ、
Ⅲ),测得了不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图所示,请回答问题:

①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是 (选填编号)。
A.改用高效催化剂
B.升高温度
C.缩小容器体积
D.分离出甲醇
E.增加CO2的浓度
②据图可知当温度高于260℃后,CO的浓度随着温度的升高而 (填“增大”、“减小”、“不变”或“无法判断”),其原因是 。
本题答案:(共16分)
(1)△H2=+41.19kJ?mol-
本题解析:
试题分析:(1)根据盖斯定律,反应Ⅱ=反应Ⅰ-反应Ⅲ,计算反应的△H2=-49.58+90.77=+41.19kJ?mol-1;反应Ⅲ是放热的,熵减的反应,自发进行条件较低温。(2)①因为反应是放热反应,所以选择较低温度,增加氢气的量,可以提高二氧化碳的平衡转化率,所以选B。②a.氢气的平均速率为1.5×60%×3/2/10=0.135mol?L-1?min-1。
b. CO2(g)+3H2(g) CH3OH(g) +H2O(g)
CH3OH(g) +H2O(g)
起始的物质的量浓度1.5 0.75 0 0
改变的物质的量浓度1.35 0.45 0.45 0.45
平衡的物质的量浓度0.15 0.3 0.45 0.45
c.温度升高,反应速率加快,达到平衡的时间缩短,但温度升高平衡逆向移动,所以平衡时甲醇的浓度在0.315mol/L左右,所以变化如图:
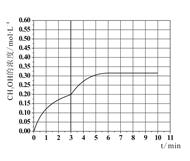
(3)①A.改用高效催化剂,能提高反应速率,但不能提高甲醇的生成量,不选;B.升高温度,反应速率加快,平衡逆向移动,不选;C.缩小容器体积,压强增大,反应速率加快,平衡正向移动,选;D.分离出甲醇,甲醇浓度减小,反应速率减慢,平衡正向移动,不选;E.增加CO2的浓度,反应速率加快,平衡正向移动,提高甲醇的生成量,选;所以选CE。②反应I、反应III均为放热反应,温度升高不利于CO2、CO转化为甲醇;反应II为吸热反应,温度升高使更多的CO2转化为CO。综上所述,CO的浓度一定增大。
考点:盖斯定律,化学平衡移动原理,化学平衡计算
本题所属考点:【热化学方程式】
本题难易程度:【困难】
He that thinks too much of his virtues bids others think of his vice. 念念不忘自己长处的人,使别人想起他的缺点。