|
|
|
已知反应:CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41 kJ【化学反应与能量】
2016-12-27 09:55:49
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 已知反应:CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41 kJ·mol-1和2H2(g)+O2(g)===2H2O(g) ΔH=-484 kJ·mol-1。则下列说法不正确的是
A.CO转化为CO2的热化学方程式为2CO(g)+O 2(g)===2CO2(g)ΔH=-566 kJ·mol-1
B.CO燃烧热的热化学方程式为CO(g)+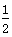 O2(g)===CO2(g) ΔH=-283 kJ·mol-1 O2(g)===CO2(g) ΔH=-283 kJ·mol-1
C.放热反应可能需要加热才能进行,而吸热反应一定需要加热才能进行
D.1mol H2完全燃烧生成1mol 液态水,放出的热量大于242 kJ
|
选择题 &nbs p;已知反应:CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41 kJ·mol-1和2H2(g)+O2(g)===2H2O(g) ΔH=-484 kJ·mol-1。则下列说法不正确的是
A.CO转化为CO2的热化学方程式为2CO(g)+O2(g)===2CO2(g)ΔH=-566 kJ·mol-1
B.CO燃烧热的热化学方程式为CO(g)+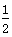 O2(g)===CO2(g) ΔH=-283 kJ·mol-1 O2(g)===CO2(g) ΔH=-283 kJ·mol-1
C.放热反应可能需要加热才能进行,而吸热反应一定需要加热才能进行
D.1mol H2完全燃烧生成1mol 液态水,放出的热量大于242 kJ
|
本题答案:C
本题解析:
试题解析:根据盖斯定律,已知方程式?×2+?得:2CO(g)+O2(g)===2CO2(g)ΔH=-566 kJ·mol-1,故A正确;由A知,B正确;吸热反应不一定需要加热才能进行,故C错误;由2H2(g)+O2(g)===2H2O(g) ΔH=-484 kJ·mol-1知,1mol H2完全燃烧生成1mol 液态水,放出的热量大于242 kJ,故D正确。
考点:化学反应与能量
本题所属考点:【化学反应与能量】
本题难易程度:【一般】
Hope is a good breakfast, but it is a bad supper. 希望是美好的早餐,却是糟糕的晚餐.