微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 绿矾(FeSO4·7H2O)硫酸法生产一种稀有金属产品过程中产出的副产品,产品外观为淡绿色或淡黄绿色结晶固体。加入适量可调节碱性水中的pH,与水中悬浮物有机结合,并加速沉淀,主要应用于水质净化和工业废水处理,同时具有杀菌作用。
(1)98% 1.84 g/cm3的浓硫酸在稀 91exam .org释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为 (保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为 (填>、<、=")40%" 。
(2)实际生产用20%发烟硫酸(100克发烟硫酸含SO3 20克)配制稀硫酸,若用SO3·nH2O表示20%的发烟硫酸,则n=____________(保留两位小数)。
(3)绿矾在空气中容易被部分氧化为硫酸铁,现取7.32克晶体溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32克;再通入112mL(标准状况)氯气恰好将Fe2+完全氧化,推测晶体的化学式为 。
(4)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在分析化学中常用来配制Fe2+的标准溶液,用此Fe2+的标准溶液可以测定剩余稀硝酸的量。现取8.64克Cu2S和CuS的混合物用200 mL 2 mol/L稀硝酸溶液处理,发生反应如下:
10NO3-+3Cu2S+16H+=6Cu2++10NO↑+3SO42-+8H2O
8NO3-+3CuS+8H+=3Cu2++3 SO42-+8NO↑+ 4H2O
剩余的稀硝酸恰好与V mL 2 mol/L (NH4)2Fe(SO4)2溶液完全反应。
已知:NO3-+3Fe2++4H+= NO↑+3Fe3++2H2O
①V值范围 ;
②若V=48,试计算混合物中CuS的质量分数 (保留两位小数)。
填空题 绿矾(FeSO4·7H2O)硫酸法生产一种稀有金属产品过程中产出的副产品,产品外观为淡绿色或淡黄绿色结晶固体。加入适量可调节碱性水中的pH,与水中悬浮物有机结合,并加速沉淀,主要应用于水质净化和工业废水处理,同时具有杀菌作用。
(1)98% 1.84 g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为 (保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为 (填>、<、=")40%" 。
(2)实际生产用20%发烟硫酸(100克发烟硫酸含SO3 20克)配制稀硫酸,若用SO3·nH2O表示20%的发烟硫酸,则n=____________(保留两位小数)。
(3)绿矾在空气中容易被部分氧化为硫酸铁,现取7.32克晶体溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32克;再通入112mL(标准状况)氯气恰好将Fe2+完全氧化,推测晶体的化学式为 。
(4)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在分析化学中常用来配制Fe2+的标准溶液,用此Fe2+的标准溶液可以测定剩余稀硝酸的量。现取8.64克Cu2S和CuS的混合物用200 mL 2 mol/L稀硝酸溶液处理,发生反应如下:
10NO3-+3Cu2S+16H+=6Cu2++10NO↑+3SO42-+8H2O
8NO3-+3CuS+8H+=3Cu2++3 SO42-+8NO↑+ 4H2O
剩余的稀硝酸恰好与V mL 2 mol/L (NH4)2Fe(SO4)2溶液完全反应。
已知:NO3-+3Fe2++4H+= NO↑+3Fe3++2H2O
①V值范围 ;
②若V=48,试计算混合物中CuS的质量分数 (保留两位小数)。
本题答案:(1)7.14 mol·L-1 ; >(各2分)
本题解析:试题分析:(1)密度为1.4g/cm3,50%的硫酸物质的量浓度为:
c= ="7.14" mol·L-1,
="7.14" mol·L-1,
50%的硫酸与30%的硫酸等体积(假设羰基为1,密度分别是ρ1和ρ2)混合,混合酸的浓度为
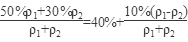 >40%。
>40%。
(2)因为20%发烟硫酸为80克H2SO4含SO3 20克,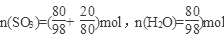 ,
,
若用SO3·nH2O表示20%的发烟硫酸,则n=0.77。
(3)配制溶液加入足量的BaCl2溶液,过滤得沉淀9.32克,n(SO42-)=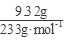 =0.04mol;再通入112mL(标准状况)氯气恰好将Fe2+完全氧化(2Fe2++Cl2==2Fe3++2Cl-),n(Fe2+)=2×
=0.04mol;再通入112mL(标准状况)氯气恰好将Fe2+完全氧化(2Fe2++Cl2==2Fe3++2Cl-),n(Fe2+)=2× =0.01mol;由电荷守恒n(Fe3+)=0.02mol, 7.32克晶体含有0.01molFeSO4为1.52g、0.01mol Fe2(SO4)3为4.00g,还有H2O为1.80g即0.1mol,晶体的化学式FeSO4·Fe2(SO4)3·10H2O。
=0.01mol;由电荷守恒n(Fe3+)=0.02mol, 7.32克晶体含有0.01molFeSO4为1.52g、0.01mol Fe2(SO4)3为4.00g,还有H2O为1.80g即0.1mol,晶体的化学式FeSO4·Fe2(SO4)3·10H2O。
(4)假设固体混合物全部为CuS,则n(CuS)= =0.09mol,需要硝酸的物质的量为y,
=0.09mol,需要硝酸的物质的量为y,
8NO3-+3CuS + 8H+==3Cu2++3SO42-+8NO↑+4H2O,
3 8
0.09mol y
y=0.24mol
剩余的硝酸的物质的量为:0.4mol-0.24mol=0.16mol。
0.112mol硝酸和(NH4)2Fe(SO4)2溶液完全反应。
NO3-+3Fe2++4H+==NO↑+3Fe3++2H2O
3mol 4
1×10-3VL×2mol/L 0.16mol,解得V=60,
所以V值范围为:42<V<60,
②若V=48,与48mL(NH4)2Fe(SO4)2溶液完全反应需要硝酸的物质的量为:
NO3-+3Fe2+ + 4H+→NO↑+3Fe3++2H2O
3mol 4
0.048L×2mol/L n
解得:n=0.128mol,
故与固体混合物反应的硝酸的物质的量为:0.4mol-0.128mol=0.272mol,
设C u2S的物质的量xmol,CuS的物质的量为ymol,160x+96y=8.64g①.
10NO3-+3Cu2S+16H+→6Cu2++10NO↑+3SO42-+8H2O
3 16
x 16x/3
8NO3-+3CuS+8H+→3Cu2++3SO42-+8NO↑+4H2O,
3 8
y 8y/3
16x/3+8y/3=0.272②
由①②解得:x=0.036; y=0.03
混合物中CuS的质量分数为: ×100%≈33.33%。
×100%≈33.33%。
本题所属考点:【有关氧化还原反应的计算】
本题难易程度:【困难】
None so deaf as those who won't hear. 不愿听人的,比聋子还聋.