微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (9分)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
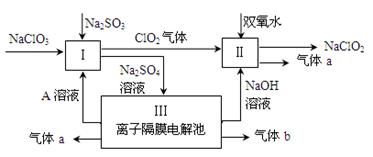
(1)Ⅰ、Ⅲ中发生反应的还原剂分别是 、 (填化学式)。
(2)Ⅱ中反应的离子方程式是 。
(3)A的化学式是 ,装置Ⅲ中A在 极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。写出该制备反应的化学方程式 。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量 。(填“相同”,“不同”或“无法判断”)
填空题 (9分)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。

(1)Ⅰ、Ⅲ中发生反应的还原剂分别是 、 (填化学式)。
(2)Ⅱ中反应的离子方程式是 。
(3)A的化学式是 ,装置Ⅲ中A在 极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。写出该制备反应的化学方程式 。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量 。(填“相同”,“不同”或“无法判断”)
本题答案:(9分)
(1) Na2SO3 H2O (
本题解析:
试题分析:氯酸钠和亚硫酸钠与溶液A发生氧化还原反应生成硫酸钠和ClO2气体,则该反应中S元素的化合价升高,所以亚硫酸钠作还原剂;生成的硫酸钠进入电解池,则实质被电解的是水,所以水是还原剂也是氧化剂;过氧化氢、ClO2气体、NaOH三种物质反应生成NaClO2和气体a,因为Cl元素的化合价降低,所以过氧化氢中O元素的化合价升高,则气体a为氧气;则气体b为氢气。
(1)根据以上分析,Ⅰ、Ⅲ中发生反应的还原剂分别是Na2SO3、 H2O;
(2)Ⅱ中反应是过氧化氢、ClO2气体、NaOH三种物质反应生成NaClO2和氧气,根据元素守恒,则产物中有水生成,所以反应的离子方程式是2ClO2 + H2O2 + 2OH-= 2ClO2-+ O2↑+ 2H2O;
(3)因为III是离子隔膜电解池,则阳极是氢氧根离子放电,导致阳极的氢离子浓度增大,硫酸根离子通过隔膜进入阳极区,所以产生氧气的一极同时产生硫酸,则溶液A的化学式为H2SO4,在阳极区产生;
(4)用亚氯酸钠和稀盐酸为原料制备ClO2,Cl元素的化合价有-1、+3、+4价,根据氧化还原反应规律,则亚氯酸钠中的Cl元素的化合价升高到+4价,同时降低到-1价,所以产物中有水、氯化钠生成,则化学方程式为5NaClO2 + 4HCl =" 5NaCl" + 4ClO2↑ + 2H2O;
(5)NaClO2变质可分解为NaClO3和NaCl,化学方程式为3 NaClO2=2NaClO3+NaCl,等质量的变质前后的NaClO2试样均配成溶液时,变质后的NaClO3和NaCl氧化亚铁离子时,实质是等量的NaClO2氧化亚铁离子,都是+3价Cl元素被还原为氯离子,转移电子的数目相同,所以消耗Fe2+的物质的量相同。
考点:考查制取亚氯酸钠的工业流程的分析,氧化还原反应的分析
本题所属考点:【有 关氧化还原反应的计算】
本题难易程度:【困难】
He was like a cock who thought the sunhad risen to hear him crow. 有的人就象公鸡一样,以为太阳因为要听它啼叫才升起。