微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在相同温度,等物质的量浓度的NaHCO3与Na2CO3溶液中,下列判断不正确的
A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c(OH-)前者大于后者
D.分别加入NaOH固体,恢复到原温度,c(CO32—)均增大
参考答案:C
本题解析:
试题分析:A.在NaHCO3溶液中存在水的电离平衡、HCO3-的电离平衡及HCO3-的水解平衡;在Na2CO3溶液中存在水的电离平衡及CO32-的水解平衡;正确;B.在NaHCO3与Na2CO3溶液中存在Na+、HCO3-、CO32-、H2CO3、H+、OH-,所以含有的粒子种类相同,正确;C.在相同温度,等物质的量浓度的NaHCO3与Na2CO3溶液中,前者存在HCO3-的电离平衡及HCO3-的水解平衡,由于水解大于电离,所以溶液显碱性,由于水解程度HCO3-<CO32-,所以溶液中c(OH-)前者小于后者,错误。D.分别加入NaOH固体,恢复到原温度,,由于增大c(OH-),所以二者的水解平衡都逆向移动,而且前者会发生反应产生正盐,产生CO32—,因此c(CO32—)均增大,正确。
考点:考查溶液中NaHCO3与Na2CO3的性质比较的知识。
本题难度:一般
2、选择题 为了除去氯化镁酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种过量的试剂,过滤后再加入适量的盐酸。这种试剂
A.氨水
B.氢氧化钠
C.碳酸钠
D.碳酸镁
参考答案:D
本题解析:试题分析:要除去氯化镁酸性溶液中的Fe3+,四个选项都可以选,但是除杂的过程中不能引入新的杂质,ABC都会引进新的杂质,D不会,所以选D。
考点:离子水解
点评:该题是基础性试题的考查,难度不大,但是要注意除杂的过程中不能引入新的杂质。
本题难度:困难
3、选择题 下列各组离子中,因相互促进水解,而不能大量共存的是
A.Al3+、SO42-、CO32-、Cl-
B.Na+、HCO3-、AlO2-、Cl-
C.H+、HS-、Na+、SO32-
D.OH-、Na+、K+、HCO3-
参考答案:A
本题解析:
试题解析:Al3+和CO32-会反应生成氢氧化铝和二氧化碳,属双水解不共存,故A正确; AlO2-、HCO3-结合生成碳酸根和氢氧化铝,属复分解反应不共存,故B错误;H+、HS-结合生成弱电解质,属复分解反应不能共存,故C错误;OH-、HCO3-结合生成水和碳酸根离子,属酸碱中和不共存,故D错误。
考点:离子共存
本题难度:一般
4、选择题 下列实验不能达到预期目的的是:
序号
| 实验操作
| 实验目的
|
A
| 配制FeCl2溶液时,向溶液中加入少量Fe和稀盐酸
| 抑制Fe2+水解和防止Fe2+被氧化
|
B
| 将饱和FeCl3溶液滴入沸水中,溶液变红褐色
| 制备Fe(OH)3胶体
|
C
| 测定等浓度的Na2CO3和Na2SO3 溶液的pH,前者pH比后者的大
| 比较S、C的非金属性强弱
|
D
| 将充满NO2的密闭玻璃球浸泡在热水中
| 研究温度对化学平衡移动的影响
参考答案:C
本题解析:
试题分析:A. Fe2+有还原性,容易被空气中的氧气氧化为Fe3+,所以配制溶液时,应该加入少量的Fe粉;FeCl2是强酸弱碱盐,容易发生水解反应使溶液变浑浊,为了防止盐水解,应该向溶液中加入少量的稀盐酸,正确;B.盐的水解反应是吸热反应,升高温度会促进盐的水解,将饱和FeCl3溶液滴入沸水中,溶液变红褐色,正确;C.由于酸性H2SO3>H2CO3,酸的酸性越强,其相应的盐水解程度就越小,所以测定等浓度的Na2CO3和Na2SO3 溶液的pH,前者pH比后者的大,可以比较溶液的酸性强弱,但是由于S、C的非金属性强弱应该看元素的最高价的含氧酸的酸性强弱,H2SO3不是最高价的含氧酸,因此不能比较其非金属性强弱,错误;D.在充满NO2的密闭玻璃球中存在可能反应:2NO2 N2O4,该反应的正反应是放热反应,将充满NO2的密闭玻璃球浸泡在热水中,根据平衡移动原理:平衡向吸热反应方向移动,产生更多的NO2,因此可以用于研究温度对化学平衡移动的影响,正确。 N2O4,该反应的正反应是放热反应,将充满NO2的密闭玻璃球浸泡在热水中,根据平衡移动原理:平衡向吸热反应方向移动,产生更多的NO2,因此可以用于研究温度对化学平衡移动的影响,正确。
考点:考查化学实验操作即完成实验目的的关系的知识。
本题难度:一般
5、选择题 下列物质中,既能发生消去反应生成烯烃,又能发生氧化反应生成醛的是( ) A.CH3OH
B.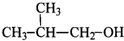
C.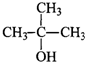
D.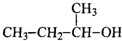
参考答案:B
本题解析:
本题难度:一般
|