微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 氢氧燃料电池的电解质溶液常见有硫酸和氢氧化钾两种,下列有关叙述不正确的是??
A.此电池能发出蓝色的火焰
B.氧气为正极,氢气为负极
C.工作时电解液一定与H2反应
D.负极:2H2+4OH-—4e-===4H2O
参考答案:ACD
本题解析:A.氢氧燃料碱性电池本质为氢气燃烧,电池总反应式为:2H2+O2=2H2O,但不会发出蓝色的火焰;
B.氢氧燃料碱性电池本质为氢气燃烧,电池总反应式为:2H2+O2=2H2O,在原电池中,负极发生氧化反应,正极发生还原反应,由于H2发生氧化反应,O2发生还原反应,所以,H2应在负极通入,O2应在正极通入.
D.写电极反应式要注意结合电解质溶液书写,如果电解质溶液不同,虽然原料相同,电极反应式也不同,如氢氧燃料电池,当电解质为酸或碱,电极反应式是不同.
本题难度:一般
2、填空题 (18分)研究SO2、NOx、CO等气体的性质对工业生产和环境保护具有重要意义。
(1)相同物质的量的SO2与NH3溶于水发生反应的离子方程式为________________,所得溶液中 _________ (填字母编号)。
_________ (填字母编号)。

(2)通过NOx传感器可监测大气中NOx的含量,其工作原理如图所示,甲、乙两电极均Pt电极,电解质为熔融氧化物。

①乙电极上发生的是_________反应(填“氧化”或“还原”);
②甲电极上的电极反应式为___________________。
(3)将不同物质的量的H2O(g)和 CO分别通入体积为2L的恒容密闭容器中,发生反应:H2O(g)+CO(g)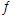 CO2(g)+H2(g) △H,得到如下数据:
CO2(g)+H2(g) △H,得到如下数据:

①由表中数据可知该反应的△H________ 0(填“>”或“<”)。
②650℃时,若在此容器中开始充入2mol H2O(g)、lmol CO、1 mol CO2和2 molH2,则反应在开始时_________进行(填“正向”或“逆向”)。
③实验III中a=______,达平衡时实验II和实验III中H2O(g)的转化率的大小关系为: (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
参考答案:(18分)
(1)SO2+NH3+H2O===NH4+
本题解析:
试题分析:(1)相同物质的量的SO2与NH3溶于水生成NH4HSO3,所以离子方程式为:SO2+NH3+H2O===NH4++HSO3-;根据电荷守恒可得:c(H+)+c(NH4+)=c(OH?)+c(HSO3?)+2c(SO32?),所以c(H+)—c(OH?)= +c(HSO3?)+2c(SO32?)—c(NH4+),根据物料守恒可得:c(NH4+)+c(NH3?H2O)=c(HSO3?)+c(H2SO3)+c(SO32?),与电荷守恒式相减可得:c(H+)—c(OH?)=c(SO32?)+c(NH3?H2O)—c(H2SO3),故答案为BD。
(2)①根据O22?移动方向可知乙为原电池的正极,发生还原反应。
②根据示意图可知NO在甲电极上与O2?反应生成NO2,电极方程式为:NO-2e-+O2-===NO2。
(3)①对比实验I与实验II数据可知,温度升高,CO的转化率减小,所以正反应为放热反应,故?H < 0。
②根据表中650℃时数据可知:H2O(g)+CO(g)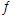 CO2(g)+H2(g)
CO2(g)+H2(g)
初始浓度(mol?L?1) 1 2 0 0
转化浓度(mol?L?1) 0.8 0.8 0.8 0.8
平衡浓度(mol?L?1) 0.2 1.2 0.8 0.8
则650℃时平衡常数K=0.8×0.8/(0.2×1.2)=2.67,充入2mol H2O(g)、lmol CO、1 mol CO2和2 molH2,浓度商Q==0.5×1/(1×0.5)="1" < K,所以开始时反应向正反应方向进行。
③根据表中反应II的数据,CO、H2O的转化量为0.4mol,则反应III的转化量也是0.4mol,所以平衡时a=1mol—0.4mol=0.6mol;实验II中H2O的初始量为1mol、CO的初始量为2mol,实验III中H2O的初始量为2mol、CO的初始量为1mol,所以实验IIH2O的转化率大于实验III。
考点:本题考查离子浓度比较、原电池原理、化学平衡常数、化学平衡。
本题难度:困难
3、选择题 某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图,电池总反应可表示为:2H2+O2=
2H2O,下列有关说法正确的是
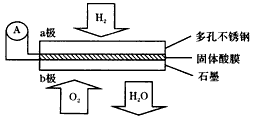 [???? ]
[???? ]
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:O2+2H2O+4e-=4OH-
C.每转移0. 1mol电子,消耗1.12L的H2
D.H+由a极通过固体酸电解质传递到b极
参考答案:D
本题解析:
本题难度:一般
4、填空题 氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
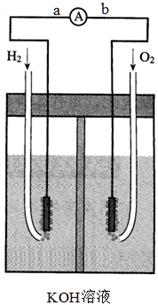
(1)氢氧燃料电池的能量转化主要形式是由 转化为 ,在导线中电流方向为 → (用a、b 表示)。
(2)正极反应式为 ,负极发生 反应(填“氧化”或“还原”)。
(3)氢氧燃料电池的能量转化率 100%(填<、>、=)。
(4)电极表面镀铂粉的原因为 。
参考答案:(12分)(1)化学能转化为电能 &#
本题解析:
试题分析:(1)该题目中,氢氧燃料电池的工作原理属于原电池原理,是将化学能转化为电能的装置,在原电池中,电流从正极流向负极,而通入燃料氢气的电极是负极,通氧气的电极是正极,所以电流从b到a,故答案为:化学能转化为电能;从b到a;
(2)燃料电池中,通入燃料氧气的电极是正极,反应式为O2+2H2O+4e-=4OH-,通入燃料氢气的电极是负极,通氧气的电极是正极,故答案为:负;
(3)在反应过程中会有部分能力损失,故氢氧燃料电池的能量转化率<100%;
(4)根据题目信息:“电池电极表面镀一层细小的铂粉,吸附气体的 能力强,性质稳定”,可知电极表面镀铂粉的原因为增大气体的吸附面积,保证气体充分参与电极反应,故答案为:增大气体的吸附面积,保证气体充分参与电极反应。
考点:常见化学电源的种类及其工作原理
点评:本题考查学生燃料电池中的有关知识,可以根据所学知识来回答,难度不大。
本题难度:一般
5、选择题 氢氧燃料电池已用于航天飞机。以30%KOH溶液为电解质的这种电池在使用时的电极反应如下:
2H2+4OH--4e-==4H2O O2+2H2O+4e-==4OH-,下列说法错误的是[???? ]
A.氢气通入正极,氧气通入负极
B.燃料电池的能量转化率不能达到100%
C.供电时的总反应为:2H2+O2==2H2O
D.产物为无污染的水,属于环境友好电池
参考答案:A
本题解析:
本题难度:一般