微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池.?某种锂电池的总反应式是Li+MnO2=LiMnO2.下列说法正确的是( )
A.Li是负极,电极反应为Li-e-=Li+
B.Li是正极,电极反应为Li+e-=Li-
C.MnO2是负极,电极反应为MnO2+e-=MnO2-
D.锂电池是一种非环保型电池
参考答案:A、根据锂电池的总反应式Li+MnO2=LiMnO2,失电子
本题解析:
本题难度:一般
2、简答题 21世纪最富有挑战性的课题之一是使汽油氧化直接产生电流,新研制的某汽油燃料电池的一个电极通入空气,另一个电极通入汽油蒸气,填写下列空格.
(1)提练汽油的原料是石油,石油是一种______(选填“可再生”或“不可再生”)能源.
(2)汽油______(选填“有”或“没有”)固定的熔沸点.
(3)汽油燃料电池的能量转换形式是将______能直接转化为______?能.
(4)通入空气的那个电极是燃料电池______极(选填“正”或“负”)该电极上若有32g?O2参加反应,则反应过程中转移了______mol.
参考答案:(1)汽油属于石油加工冶炼的产品,属于不可再生能源,故答案为
本题解析:
本题难度:一般
3、选择题 镉镍可充电电池的充、放电过程:Cd(OH)2+2Ni(OH)2 Cd+2NiOOH+2H2O由此可知,该电池放电时的负极是 [???? ]
Cd+2NiOOH+2H2O由此可知,该电池放电时的负极是 [???? ]
A.Cd
B.NiOOH
C.Cd(OH)2
D.Ni(OH)2
参考答案:A
本题解析:
本题难度:简单
4、填空题 (11分)工业上将煤气化过程中生成的CO和H2在一定条件下反应制得甲醇,反应的方程式为:CO(g)+2H2(g)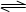 CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:
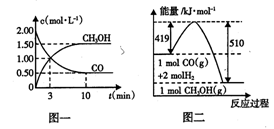
(1)从反应开始到平衡,用H2浓度变化表示的平均反应速率v(H2) =____ ;平衡时CO的转化率为____ 。
(2)该反应的平衡常数表达式为 ;若升高反应温度,该反应的平衡常数将 (填“增大”、“减小”或“不变”)。
(3)若在一定温度下,向一恒压容器中充人1 mol CO、2mol H2和1 mol CH3OH,反应达到平衡时,测得混合气体的密度是同温同压下起始混合气体密度的0.8倍,则到达平衡状态前该反应向____ (填“正”或“逆”)反应方向进行。
(4)根据图二,甲醇分解的热化学方程式为 。
(5)若以甲醇为原料制成燃料电池,在碱性介质中负极的电极反应式为____ 。
参考答案:(1)0.3 mol/(L?min) ,75% (2)c(C
本题解析:
试题分析:(1)从反应开始到平衡,用CO浓度变化表示的平均反应速v(CO)=(2.00-0.50)mol/L÷10min=0.15mol/(L?min);由于v(H2)=2V(CO),所以v(H2)=" 0.3" mol/(L?min);平衡时CO的转化率为(1.5mol/L÷2.00mol/L)×100%=75%,(2)该反应的平衡常数表达式为K=c(CH3OH)/c(CO)·c2(H2),由于反应物的能量高于生成物,所以该反应是放热反应。根据平衡移动原理,若升高反应温度,平衡向吸热的逆反应方向移动,该反应的平衡常数将减小;(3)由于反应前后气体的质量不变,若在一定温度下,向一恒压容器中充人1 mol CO、2mol H2和1 mol CH3OH,反应达到平衡时,测得混合气体的密度是同温同压下起始混合气体密度的0.8倍,密度减小,说明反应后气体的体积增大,反应逆向进行,为使越强与原来相等就应该扩大容器的容积,故到达平衡状态前该反应向逆反应方向进行。(4)根据图二可知1mol的甲醇分解产生1mol的CO和2mol的H2,反应需要吸热(510-419)KJ=91 KJ,所以甲醇分解的热化学方程式为CH3OH(g) CO(g)+2H2(g) ΔH="+91" KJ/mol ;(5)若以甲醇为原料制成燃料电池,通入甲醇的电极为负极,在碱性介质中负极的电极反应式为CH3OH+8OH- -6e-=CO32-+6H2O。
CO(g)+2H2(g) ΔH="+91" KJ/mol ;(5)若以甲醇为原料制成燃料电池,通入甲醇的电极为负极,在碱性介质中负极的电极反应式为CH3OH+8OH- -6e-=CO32-+6H2O。
考点:考查化学反应速率的计算、物质的平衡转化率、反应进行的方向的判断、热化学方程式的书写及原电池反应的电极式的书写的知识。
本题难度:困难
5、选择题 锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时的电极反应式为 负极反应:C6Li-xe-==C6Li1-x+xLi+ (C6Li表示锂原子嵌入石墨形成的复合材料)正极反应:Li1-xMO2+xLi++xe-==LiMO2(LiMO2表示含锂的过渡金属氧化物)。下列有关说法正确的是 [???? ]
A.锂离子电池充电时电池反应为C6Li+Li1-xMO2==LiMO2+C6Li1-x
B.电池反应中,锂、锌、银、铅各失去1 mol电子,金属锂所消耗的质量小
C.锂离子电池放电时电池内部Li+向负极移动
D.锂离子电池充电时阴极反应为C6Li1-x+xLi++xe-==C6Li
参考答案:BD
本题解析:
本题难度:一般