微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 IT产业中一些车间要求必须做到无尘生产,工人在车间工作时的服装需经静电除尘处理。这种处理方法应用的原理是
A.胶体的丁达尔现象
B.胶体的布朗运动
C.胶体的电泳
D.渗析
参考答案:C
本题解析:
本题难度:困难
2、计算题 (6分)Ⅰ.取1.43g Na2CO3·XH2O 溶于水配成10ml 溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸 2.0ml,并收集到112ml CO2(标况)。
(1)稀盐酸物质的量浓度为___________。
(2)Na2CO3·xH2O的摩尔质量为___________。
(3)x=_______。
Ⅱ.在智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,化学方程式是:
2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O
(1)用“双线桥”标出电子转移的方向和数目。
(2)反应产物中,氧化产物与还原产物的物质的量之比为 。
参考答案:Ⅰ. (1)5 mol·L-1(2)286g·mol-1(3
本题解析:
试题分析:Ⅰ.(1)n(CO2)=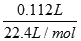 =0.005mol,
=0.005mol,
Na2CO3 + 2HCl = 2NaCl+CO2↑+H2O
1 2 1
n(Na2CO3) n(HCl) 0.005mol
(1)n(HCl)=2×n(CO2)=2×0.005mol=0.01mol,c(HCl)= =5.0mol/L,故答案为:5.0mol/L;(2)n(Na2CO3?xH2O)=n(Na2CO3)=0.005mol,M(Na2CO3?xH2O)=286g/mol,故答案为:286g/mol; (3)由摩尔质量可知:106+18x=286,x=10,故答案为:10.
=5.0mol/L,故答案为:5.0mol/L;(2)n(Na2CO3?xH2O)=n(Na2CO3)=0.005mol,M(Na2CO3?xH2O)=286g/mol,故答案为:286g/mol; (3)由摩尔质量可知:106+18x=286,x=10,故答案为:10.
Ⅱ.(1)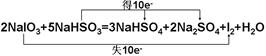
(2)反应中S元素的化合价升高,则S元素失去电子被氧化,生成硫酸钠,I元素的化合价降低,则NaIO3为氧化剂,由化合价变化可知生成1mol氧化产物转移2mol电子,生成1mol还原产物,转移10mol电子,根据转移电子数守恒知,氧化产物与还原产物的物质的量比为5:1.
考点:氧化还原反应
本题难度:一般
3、选择题 “铜绿”即是铜锈,它的化学成分是Cu2(OH)2CO3(碱式碳酸铜)。铜在潮湿的空气中生锈的化学反应为2Cu+O2+CO2+H2O====Cu2(OH)2CO3。下列有关该反应的说法正确的是 ( )
A.该反应不是氧化还原反应
B.该反应中氧元素和碳元素化合价发生变化,所以是氧化还原反应
C.该反应中铜得电子,O2失电子,所以是氧化还原反应
D.该反应是氧化还原反应,变价的只有两种元素
参考答案:D
本题解析:
试题分析:在该反应中,铜元素的化合价由0价变成+2价,失去电子,被氧化,氧元素的化合价由0价变成-2价,得到电子,被还原,其余元素的化合价都没有发生变化。
考点:氧化还原反应
本题难度:一般
4、选择题 下列溶液中,Cl-的物质的量浓度与50mL 1mol·L-1 AlCl3溶液中Cl-浓度相等的是
A.150mL 1mol·L-1 NaCl溶液
B.25mL 3mol·L-1 MgCl2溶液
C.150mL 3mol·L-1 KClO3溶液
D.75mL 1mol·L-1 FeCl3溶液
参考答案:D
本题解析:试题分析:1mol·L-1 AlCl3溶液中Cl-浓度为3 mol·L-1。KClO3电离生成K+和ClO3-,KClO3溶液中无Cl-;A、B、D中Cl-浓度分别为1 mol·L-1、6 mol·L-1、3 mol·L-1。
考点:化学计算
点评:溶液具有均一性,溶液浓度与体积无关;KClO3中酸根离子是ClO3-,溶液中不存在Cl-;HCl气体、CCl4中也不存在Cl-。
本题难度:困难
5、选择题 在2L密闭容器中,发生3A(气)+B(气)?==2C(气)的反应,若最初加入A和B都是4mol,A的平均反应速率为0.12mol/(L·s),则10秒钟后容器中B的物质的量为
A.2.8mol
B.1.6mol
C.3.2mol
D.3.6mol
参考答案:C
本题解析:由于反应速率之比是相应的化学计量数之比,所以根据A的反应速率可知,B的反应速率是0.12mol/(L·s)÷3=0.04mol/(L·s)。所以B的物质的量变化是0.04mol/(L·s)×10s×2L=0.8mol,因此剩余B是4mol-0.8mol=3.2mol,答案选C。
本题难度:一般