微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 工业上由FeS2制H2SO4的转化关系如下:
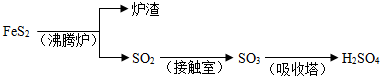
填写下列空白:
(1)已知吸收塔中每40gSO3气体被水完全吸收生成液态硫酸放出65.15kJ,写出该反应的热化学方程式______;
(2)接触室内发生的反应为:
SO2(g)+
1
2
O2(g)?催化剂
.
△
SO3(g)△H=a?kJ?mol-1
下表为不同温度(T)下该反应的化学平衡常数(K):
| T/K | 673 | 723 | 823 | 923
K
423
37.4
20.5
4.68
①根据上表数据及化学平衡理论,上述反应中a______0(填“>”或“<”);
②K值越大,表明反应达到平衡时______(填标号).
A.SO2的转化率一定越高 B.SO3的产量一定越大
C.正反应进行得越完全 ??D.化学反应速率越大
(3)考虑综合经济效益,当炉渣含铁量大于45%时,可用于制硫酸亚铁等.下列利用炉渣里的Fe2O3制FeSO4的方案中,最能体现绿色化学理念的方案是______(填标号);
A.Fe2O3CO
高温
Fe浓硫酸
FeSO4;B.Fe2O3浓硫酸
Fe2(SO4)3铁屑
FeSO4;C.Fe2O3铁粉
高温
Fe浓硫酸
FeSO4
(4)为了探究接触室里催化剂颗粒(粗颗粒和细颗粒),反应的温度(673K和723K),反应的压强(101Kpa和1010Kpa)对反应速率的影响,通过变换这些实验条件,至少需要完成______个实验然后进行对比得出结论;
(5)为实现绿色环保、节能减排和废物利用等目的,某硫酸厂用碳酸钙作吸收剂与水配成浆液,洗涤尾气(SO2的体积分数为0.200%)并吸收SO2,得到石膏(CaSO4?2H2O).求:22.4m3(标准状况下)的尾气可制得石膏______千克;(取两位有效数字)(设二氧化硫的利用率为80.0%?)
(6)科学家研究出以图所示装置用电化学原理生产硫酸的新工艺,其阳极的电极反应式为______,总反应的化学方程式为______.
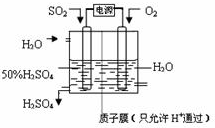
参考答案:(1)40gSO3气体物质的量为0.5mol,生成液态硫酸放
本题解析:
本题难度:一般
2、计算题 (每空2分共8分)在由铜锌组成的原电池(电解质是稀硫酸)中,有位同学在铜电极收集到了12 g的气体,(1) 铜锌原电池的正、负极的电极反应:
正极:_______________________________?负极:____________________________??
(2) 铜电极产生12 g气体的过程中有___??? __g的锌溶解。
(3) 铜电极产生12 g气体的过程中有___???? __mol的电子发生了转移。
参考答案:
 本题解析:略 本题解析:略
本题难度:简单
3、选择题 银制器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故.根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去.下列说法正确的是( )
A.处理过程中银器一直保持恒重
B.银器为正极,Ag2S被还原生成单质银
C.该过程中总反应为2Al+3Ag2S═6Ag+Al2S3
D.黑色褪去的原因是黑色Ag2S转化为白色AgCl
参考答案:A.银器放在铝制容器中,由于铝的活泼性大于银,故铝为负极,失
本题解析:
本题难度:一般
4、填空题 自发的氧化还原反应可以设计成原电池。若利用反应“Cu+2Ag+=2Ag?+Cu2+?”设计一个原电池,回答下列问题:??
①该电池的负极是__________,正极上反应的离子是________。
②在外电路中,电子流动方向从_________极流向________极(填“正”或“负”)。内电路中,阳离子移向_______(填“正极”或“负极”)。
参考答案:①Cu;Ag+??
② 负;正; 正极
本题解析:
本题难度:一般
5、选择题 有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯
(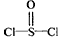 )中而形成的,电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S,下列叙述中正确的是[???? ] )中而形成的,电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S,下列叙述中正确的是[???? ]
A.电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的正极,石墨作电池的负极
C.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4:l
参考答案:D
本题解析:
本题难度:一般
网站客服QQ: 960335752 - 14613519 - 791315772
|
|
|