微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 甲基醌(维生素K)有止血作用,它可通过2-甲基萘经氧化而制得。反应中常用醋酸作催化剂,且该反应为放热反应下图,可表示为:
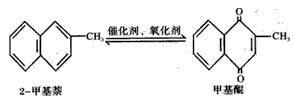
在某次合成中用1. 4g(0.01mol)2-甲基萘仅制得0.17g(0.001mol)甲基醌,已知该反应的速度是很快的,判断导致其产率降低的原因可能是 [???? ]
A.使用了少量的氧化剂
B.催化剂用量不足
C.温度过高
D.生成的甲基醌是沉淀物
参考答案:C
本题解析:
本题难度:一般
2、实验题 I.下列四支试管中,过氧化氢分解的化学反应速率最大的是????????
试管
| 温度
| 过氧化氢浓度
| 催化剂
|
a
| 室温(25℃)
| 12%
| 有
|
b
| 水浴加热(50℃)
| 4%
| 无
|
c
| 水浴加热(50℃)
| 12%
| 有
|
d
| 室温(25℃)
| 4%
| 无
II.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
实验编号
| 反应物
| 催化剂
| ①
| 10mL2% H2O2溶液
| 无
| ②
| 10mL5% H2O2溶液
| 无
| ③
| 10mL5% H2O2溶液
| 1mL0.1mol·L-1FeCl3溶液
| ④
| 10mL5% H2O2溶液+少量HCl溶液
| 1mL0.1mol·L-1FeCl3溶液
| ⑤
| 10mL5% H2O2溶液+少量NaOH溶液
| 1mL0.1mol·L-1FeCl3溶液
(1)实验①和②的目的是____________________________。
(2)写出实验③的化学反应方程式??????????????????????????????。
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。
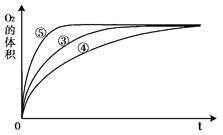
分析上图能够得出的实验结论是??????????_________________________。
参考答案:I.c(2分)
II.(1)探究浓度对反应速率的影响?
本题解析:
试题分析:I温度越大,化学反应速率越大,催化剂可以提高化学反应的反应速率,所以过氧化氢分解的化学反应速率最大的是c;
II.(1)①和②中所以的过氧化氢的浓度不同,其他条件相同,所以①和②的目的是探究浓度对反应速率的影响;(2)实验③采用了FeCl3作为催化剂,所以实验③的化学反应方程式为2H2O2
本题难度:一般
3、选择题 决定化学反应速率的主要因素是
[???? ]
A.参加反应的物质本身的性质
B.催化剂
C.温度、压强以及反应物的接触面
D.反应物的浓度
参考答案:A
本题解析:
本题难度:一般
4、选择题 活化分子是衡量化学反应速率快慢的重要依据,下列说法中不正确的是(??)
A.增大压强,可使活化分子数增多,反应速率加快
B.增大反应物的浓度,可使单位体积内活化分子数增多,反应速率加快
C.能够发生有效碰撞的分子一定是活化分子
D.升高温度,使单位体积内活化分子百分数大大增加
参考答案:A
本题解析:
试题分析:A选项错误,增大压强能够使活化分子浓度增大,活化分子数目不变。B选项正确,反应物浓度增大,活化分子数增大。C选项争取,发生有效碰撞的前提必须是活化分子。D选项,正确。温度升高,内能增大,可以使活化分子数增大。
本题难度:一般
5、选择题 对某一可逆反应来说,使用催化剂的作用是
[???? ]
A.提高反应物的平衡转化率
B.以同样程度改变正逆反应的速率
C.增大正反应速率,减小逆反应速率
D.改变平衡混合物的组成
参考答案:B
本题解析:
本题难度:简单
|
|