微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如图所示,当向试管内通入21mL O2时,最后试管中的液面仍在原来的位置,则原试管中NO为
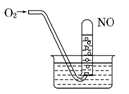
A.6 mL
B.12 mL
C.16 mL
D.18 mL
参考答案:B
本题解析:略
本题难度:一般
2、选择题 氮族元素随着核电荷数的增加,递变规律正确的是(???)
A.非金属性逐渐增强
B.熔沸点逐渐降低
C.RH3还原性逐渐增强
D.最高价氧化物对应的水化物的酸性逐渐增强
参考答案:C
本题解析:氮族元素从上至下,金属性逐渐增强,非金属性逐渐减弱;单质的熔沸点逐渐升高;氢化物的稳定性逐渐减弱,还原性逐渐增强;而最高价氧化物对应的水化物的酸性逐渐减弱。
本题难度:简单
3、实验题 固态化合物A由两种短周期元素组成,可与水发生复分解反应,甲组同学用如图装置(夹持装置略)对其进行探究实验。
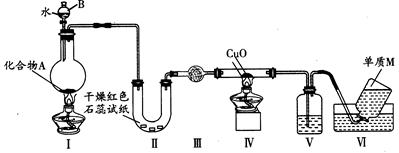
(1)仪器B的名称是?????????????????????。
(2)实验中,Ⅱ中的试纸变蓝,Ⅳ中黑色粉末逐渐变为红色并有M生成,则Ⅲ中的试剂为__________________;Ⅳ发生反应的化学方程式为????????????????????????????????;Ⅴ中的试剂为____________________。
(3)乙组同学进行同样实验,但装置连接顺序为Ⅰ→Ⅲ→Ⅳ→Ⅱ→Ⅴ→Ⅵ,此时Ⅱ?中现象为?????????????????,原因是????????????????????????????????????????????????。
(4)经上述反应,2.5g 化合物A理论上可得0.56L(标准状况)M;则A的化学式为________________。
参考答案:(1)分液漏斗
(2)碱石灰(或氧化钙) 3CuO+2
本题解析:(1)根据B的结构特点可知,B是分液漏斗。
(2)Ⅱ中的试纸变蓝,说明反应中有氨气生成。氨气具有还原性,能还原氧化铜。但在和氧化铜反应之前,需要干燥氨气,所以Ⅲ中的试剂为碱石灰,和氧化铜反应的方程式为3CuO+2NH3 3Cu+N2+3H2O。由于氨气是过量的,所以需要用浓硫酸吸收剩余的氨气,即中的试剂为浓
3Cu+N2+3H2O。由于氨气是过量的,所以需要用浓硫酸吸收剩余的氨气,即中的试剂为浓
本题难度:一般
4、计算题 (12分)(1)在浓硝酸中放入铜片。
①开始反应的化学方程式为___________________________________
②若铜有剩余,则反应将要结束时的反应的离子方程式是?????????。
③待反应停止后,再加入少量的25%的稀硫酸,这时铜片上又有气泡产生,其原因是
_____________________________________________________。
(2) 在100mL混合酸中,c(HNO3) = 0.4mol·L-1,c(H2SO4) = 0.2mol·L-1,向其中加入2.56g铜粉,微热,待充分反应后,溶液中Cu2+的物质的量浓度为?????????。
(3)14g铜银合金与过量的某浓度的硝酸溶液反应,待放出的气体与1.12L(标准状况下)氧气混合通入水中,恰好全部被水吸收,则合金中铜的质量是????????。
参考答案:(12分)
(1)① Cu + 4HNO3(浓)= C
本题解析:(1)铜与硝酸反应与其浓度有关:
Cu + 4HNO3(浓)= Cu(NO3)2 + 2NO2↑ + 2H2O
3Cu + 8HNO3(稀)="3" Cu(NO3)2 + 2NO↑ + 4H2O
③待反应停止后,再加入少量的25%的稀硫酸提供H+,溶液中的NO3-可继续氧化铜
(2)NO3-、H+、Cu均为0.04mol,结合下面的离子方程式:
3Cu ??+ ??8H+??+??2NO3- =3Cu2+ + 2NO↑ + 4H2O
0.015mol?? 0.04mol
本题难度:一般
5、填空题 (8分) 化合物A俗称石灰氮,以前是一种常用的肥料,其含氮量为35.0%,含钙量为50%。它可以用CaCO3通过下列步骤制得:

请回答下列问题:
(1)写出化学式:A________________、B________________;
(2)CaC2是__________________(填“离子”或“共价”)化合物;
(3)A与水完全反应的现象是产生白色沉淀并放出有刺激性气味的气体,写出A与水完全反应的化学方程式_______________________________________________________。
参考答案:
(1) CaCN2?(2分)??????CaO(2分
本题解析:略
本题难度:简单