微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 实验室里用二氧化锰与浓盐酸反应来制取适量的氯气。现用100ml的浓盐酸与二氧化锰反应,生成的氯气在标准状况时的体积为5.6升,计算:
(1)理论上需要参加反应的二氧化锰多少克?
(2)浓盐酸的物质的量浓度为多少?
(3)被氧化的HCl的质量为多少克?
参考答案:
(1)21.75g
(2)10mol/L
本题解析:
本题难度:一般
2、选择题 水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH-Fe3O4+S4O62-+2H2O,下列说法中,正确的是( ? )
A.每生成1?mol?Fe3O4,反应转移的电子总数为4?mol
B.Fe2+和S2O32-都是还原剂
C.1?mol?Fe2+被氧化时,被Fe2+还原的O2的物质的量为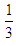 mol
mol
D.x=2
参考答案:AB
本题解析:
本题难度:一般
3、选择题 以惰性电极电解CuSO4溶液。若阳极上产生气体的物质的量为0.0100mol,则阴极上析出Cu的质量为 [???? ]
A.0.64g
B.1.28g
C.2.56g
D.5.12g
参考答案:B
本题解析:
本题难度:一般
4、选择题 两种硫酸盐按一定比例混合后共熔,可制得化合物X且X溶于水能电离出K+、Cr3+、SO42-,若将2.83g?X中的Cr3+全部氧化为Cr2O72-后,溶液中的Cr2O72-可和过量KI溶液反应,得到3.81gI2,反应的离子方程式为:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O.若向溶有2.83gX的溶液中,加入过量的BaCl2溶液,可得到4.66g白色沉淀.由此可推断出X的化学式为( )
A.K2SO4?2Cr2(SO4)3
B.2K2SO4?Cr2(SO4)3
C.K2SO4?Cr2(SO4)3
D.K2SO4?
1
2
Cr2(SO4)3
参考答案:令2.83g?X中的Cr3+的物质的量为xmol,则:
本题解析:
本题难度:简单
5、选择题 下列变化,需要加入还原剂才能实现的是
A.H2S→SO2
B.H2SO4→SO2
C.C→CO2
D.Cl2→HClO
参考答案:B
本题解析:分析:需要加入还原剂才能实现,说明所给物质作氧化剂,在反应中得电子化合价降低,据此分析解答.
解答:A.H2S→SO2中硫元素化合价升高,则需要加入氧化剂才能实现,故A错误;
B.H2SO4→SO2中硫元素化合价降低,则需要加入还原剂才能实现,如铜,故B正确;
C.C→CO2中碳元素化合价升高,则需要加入氧化剂才能实现,如氧气,故C错误;
D.Cl2→HClO中氯元素的化合价升高,和氢氧化钠的反应中氯气既作氧化剂又作还原剂,所以加入氢氧化钠也能实现,故D错误;
故选B.
点评:本题考查氧化还原反应,明确氧化剂、还原剂发生的反应及元素的化合价变化是解答本题的关键,题目难度不大.
本题难度:简单
|