微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在10mL0.1mol-L-NaOH溶液中加入同体积、同浓度的HAc溶液,反应后溶液中各微粒的浓度关系正确的是( )
A.c(Na+)>c(Ac-)>c(H+)>c(OH-)
B.c(Na+)=c(Ac-)>c(OH-)=c(H+)
C.c(OH-)=c(H+)+c(HAc)
D.2c(Na+)+c(H+)=2c(Ac-)+c(OH-)+c(HAc)
参考答案:CD
本题解析:
本题难度:简单
2、选择题 表示0.1mol/L NaHCO3溶液中有关微粒浓度大小的关系式,正确的是( ? )
A.c(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-)
B.c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
C.c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)>c(OH-)
D.c(H+)>c(H2CO3)>c(OH-)>c(HCO3-)>c(CO32-)
参考答案:B
本题解析:
本题难度:简单
3、选择题 下列实验现象描述不正确的是( )
A.Na2CO3水溶液呈碱性,所以其热溶液可以除去物品表面的油污
B.Fe(OH)3胶体能吸附水中的悬浮颗粒并沉降,因而具有净水作用
C.氯化亚铁溶液与无色的KSCN溶液混合,溶液不呈红色
D.SO2通入品红溶液,红色褪去,再加热,红色不再出现
参考答案:D
本题解析:
本题难度:一般
4、填空题 对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。若25℃时有HA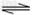 H++A-,则K=
H++A-,则K= 。式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25℃)。
。式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25℃)。

回答下列问题:
(1)当升高温度时,K值____(填“变大”“变小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?___________ ____________。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看做是酸,其中酸性最强的是_____,最弱的是_____。
(4)同一多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是______ ________,产生此规律的原因是_____________ _______________________。
(5)Na2CO3溶液呈_____(填“酸性”“碱性”或“中性”),其原因(用离子方程式表示)是____________ ___________。
(6)已知NaH2PO4溶液呈酸性,则该溶液中c(H3PO4)____c(HPO42-)(填“大于”或“小于” )。
参考答案:(1)变大??
(2)K值越大电离出的氢离子浓度越大,
本题解析:
本题难度:一般
5、选择题 下列溶液中微粒浓度关系一定正确的是 [???? ]
A.室温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl–)=c(NH4+)
B.pH=1的一元酸和pH=13的一元碱等体积混合:c(OH–)=c(H+)
C.0.1?mol/L的(NH4)2SO4溶液中:c(NH4+)>c(SO42–)>c(H+)>c(OH–)
D.0.1?mol/L的Na2S溶液中:c(OH–)=c(H+)+c(HS–)+c(H2S)
参考答案:AC
本题解析:
本题难度:一般