微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定温度下,在三个体积均为1.0L的恒容密闭容器中,充入一定量的H2和SO2发生下列反应:
3H2(g)+SO2(g) 2H2O(g)+H2S(g)
2H2O(g)+H2S(g)
容器编号
| 温度/℃
| 起始物质的量/mol
| 平衡物质的量/mol
|
H2
| SO2
| H2
| SO2
|
容器I
| 300
| 0.3
| 0.1
| /
| 0.02
|
容器II
| 300
| 0.6
| 0.2
| /
| /
|
容器III
| 240
| 0.3
| 0.1
| /
| 0.01
下列说法正确的是
A.该反应正反应为吸热反应
B.容器II达到平衡时SO2的转化率比容器I小
C.容器III达到平衡的时间比容器I短
D.240℃时,该反应的平衡常数为1.08×104L? mol-1
参考答案:D
本题解析:
试题分析:A、分析容器Ⅰ和容器Ⅲ中的数据知,降低温度,SO2的物质的量减少,平衡正向移动,该反应正反应为放热反应,错误;B、容器II相当于容器Ⅰ的体积缩小为原来的一半,平衡正向移动,达到平衡时SO2的转化率比容器I大,错误;C、容器Ⅰ的反应温度比容器Ⅲ高,反应速率快,容器III达到平衡的时间比容器I长,错误;D、分析容器Ⅲ中数据知,240℃时,[SO2]= 0.01mol/L,[H2]= 0.03mol/L,[H2O]= 0.18mol/L,[H2S]= 0.09mol/L,代入平衡常数表达式计算,该反应的平衡常数为1.08×104L? mol-1,正确。
考点:考查化学平衡的移动、数据分析能力。
本题难度:困难
2、选择题 某一反应在一定条件下的平衡转化率为25.3%,当有一催化剂存在时,其转化率为????[???? ]
A、大于25.3%??????
B、小于25.3%??????
C、等于25.3%?????
D、?约等于25.3%
参考答案:C
本题解析:
本题难度:简单
3、选择题 下列选项中的原因或结论与现象不对应的是
选项
| 现象
| 原因或结论
| A
| 在 H2O2中加入MnO2,能加速H2O2的分解速率
| MnO2降低了反应所需的活化能
| B
| 向5mL 0.005mol·L-1FeCl3溶液中加入5mL 0.015mol·L-1KSCN溶液,溶液呈红色,再滴加几滴1mol·L-1KSCN溶液,溶液颜色加深
| 增大反应物浓度,平衡向正反应方向移动
| C
| 将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深
| 该反应△H<0,平衡向生成NO2方向移动
| D
| 在密闭容器中有反应:A+xB(g) 2C(g)。达到平衡时测得c(A)为0.5mol/L,将容器容积扩大到原来的两倍,测得c(A)为0.4mol/L-1 2C(g)。达到平衡时测得c(A)为0.5mol/L,将容器容积扩大到原来的两倍,测得c(A)为0.4mol/L-1
| A非气体、x=1
参考答案:D
本题解析:
试题分析:A、MnO2为H2O2分解的催化剂,能加速H2O2的分解速率,所以MnO2降低了反应所需的活化能,故A正确;B、再滴加几滴1mol·L-1KSCN溶液,增加了反应物浓度,溶液颜色加深,说明平衡向正反应方向移动,故B正确;C、NO2为红棕色,N2O4为无色,将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深,说明NO2浓度增大,平衡向生成NO2方向移动,2NO2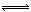 N2O4反应△H<0,故C正确;D、达到平衡时测得c(A)为0.5mol/L,将容器容积扩大到原来的两倍,测得c(A)为0.4mol/L-1,说明减压平衡向生成A的方向移动,向左的方向气体的系数增大,“A非气体、x=1”错误。 N2O4反应△H<0,故C正确;D、达到平衡时测得c(A)为0.5mol/L,将容器容积扩大到原来的两倍,测得c(A)为0.4mol/L-1,说明减压平衡向生成A的方向移动,向左的方向气体的系数增大,“A非气体、x=1”错误。
考点:本题考查催化剂、化学平衡移动。
本题难度:一般
4、选择题 在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g) nY(g);??△H=QkJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示: nY(g);??△H=QkJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
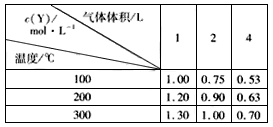
下列说法正确的是[???? ]
A.m>n
B.Q<0
C.温度不变,压强增大,Y的质量分数减少
D.体积不变,温度升高,平衡向逆反应方向移动
参考答案:C
本题解析:
本题难度:一般
5、选择题 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积v的数据,根据数据绘制得到下图,则曲线a所对应的实验组别是( )
| 组别 | c(HCl)(mol?L-1) | 温度(℃) | 状态
A
2.0
25
块状
B
2.5
30
块状
C
2.5
50
粉末状
D
2.5
50
块状
A.A
B.B
C.C
D.D
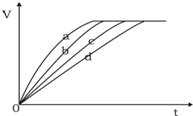
参考答案:C
本题解析:
本题难度:简单
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772