微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)请回答下列问题
(1)已知:25℃时,0.1 mol·L-1的HA溶液中c(H+)/c(OH-)=1010。
①HA是________(填“强电解质”或“弱电解质”);
②在加水稀释HA溶液的过程中,随着水量的增加而减小的是________(填字母)。
A.c(H+)/c(HA) B.c(HA)/ c (A-)
C.c(H+)与c(OH-)的乘积 D.c(OH-)
③若M溶液是由上述HA溶液V1 mL与pH = 12的NaOH溶液V2 mL混合充分反应而得,则下列说法中正确的是_______(填字母)。
A.若溶液M呈中性,则溶液M中c(H+) + c(OH-) = 2.0×10-7 mol·L-1
B.若V1 =V2 ,则溶液M的pH一定等于7
C.若溶液M呈酸性,V1一定大于V2
D.若溶液M呈碱性,V1一定小于V2
(2)若已知在25℃,AgCl的Ksp = 1.8×10-10,现将足量AgCl分别放入:①100 mL 蒸馏水中;②100 mL 0.2mol·L-1 AgNO3溶液中;③100 mL 0.1mol·L-1 AlCl3溶液中;④100 mL 0.1mol·L-1盐酸中,充分搅拌后,相同温度下c(Ag+)由大到小的顺序是 (用序号连接)
(3)对于2NO2(g)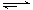 N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是 。
N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是 。

①A、C两点的反应速率:A>C
②A、C两点气体的颜色:A深、C浅
③B、C两点的气体的平均分子质量:B<C
④由状态B到状态A,可以用加热方法
参考答案:(1)①弱电解质(2分) ②B(2分)
本题解析:
试题分析:(1)①如果HA是强电解质0.1 mol·L-1的HA溶液中c(H+)=0.1mol·L-1,c(OH-)=10-13mol·L-1则有c(H+)/c(OH-)=1012,现在 c(H+)/c(OH-)=1010所以HA是弱电解质。②加水稀释,c(HA)、 c(H+)、 c (A-) 都会减小,但稀释是平衡向正向移动,c(H+)和 c (A-) 减小的较慢,c(H+)/c(HA)增大, c(HA)/ c (A-)减小;c(H+)与c(OH-)的乘积是水的离子积,不变;酸性减弱,碱性增强故c(OH-)增大,选B。③溶液显中性则c(H+) =c(OH-) = 1.0×10-7 mol·L-1,A对;若V1 =V2 ,酸过量,溶液显酸性,B错;酸的浓度大,碱的浓度小,所以酸的体积小混合溶液也会显酸性,C错;由于酸的浓度较大,溶液要显碱性,碱的用量要大,故D对,选A D。(2)①100 mL 蒸馏水中;c(Ag+)= Ksp 1/2= (1.8×10-10)1/2=1.3×10-5 mol·L-1;②100 mL 0.2mol·L-1 AgNO3溶液中;c(Ag+)= 0.2mol·L-1;③100 mL 0.1mol·L-1 AlCl3溶液中;c(Ag+)=1.8×10-10÷0.3=6.0×10-10mol·L-1;④100 mL 0.1mol·L-1盐酸中,c(Ag+)=1.8×10-10÷0.1=1.8×10-9mol·L-1,故c(Ag+)浓度大小顺序为:②>①>④>③。(3)A、C两点温度相同,C点的压强较大,故C点的反应速率较快,①错;A点NO2的体积分数较大,浓度也较大,故A点的颜色较深,②对;.B、C两点NO2的体积分数相同,所以相对分子质量也相等,③错;状态B到状态A是要增大NO2的体积分数,是平衡向逆向移动反应时放热反应,故升高温度可使平衡向逆向移动,④对选②、④
考点:强弱电解质的判断,溶液混合时的离子浓度大小比较、有关Ksp的计算和化学平衡的移动。
本题难度:困难
2、选择题 一定条件下,体积为2L的密闭容器中,1mol A和1mo1 B进行反应:A(g)+3B(g)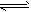 2C(g)经2分钟反应达到平衡,此时生成0.2mol C。 下列说法正确的是
2C(g)经2分钟反应达到平衡,此时生成0.2mol C。 下列说法正确的是
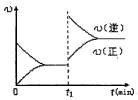 [???? ]
[???? ]
A.反应开始至2分钟时,以B浓度变化表示的反应速率为0.05mol/(L·min)
B.反应开始至2分钟时,A的转化率为5%
C.若其他条件不变,升高温度,A的体积分数增大,则该反应的△H<0
D.若其他条件不变,增大压强,化学反应速率的变化符合上图
参考答案:C
本题解析:
本题难度:一般
3、选择题 将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g),若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,下列几种说法中不正确的是:
2C(g),若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,下列几种说法中不正确的是:
A.用物质 A 表示的反应的平均速率为 0.3 mol
参考答案:
本题解析:
本题难度:一般
4、选择题 一定温度下,可逆反应N2(g)+3H2(g) 2NH3 (g) 达到平衡状态标志的是
2NH3 (g) 达到平衡状态标志的是
A.A、B、C的分子数之比为1:3:2
B.单位时间内生成amol N2,同时生成amolNH3
C.每断裂1molN≡N,同时断裂3molH-H
D.每生成1mol N≡N,同时生成6molN-H
参考答案:D
本题解析:
试题分析:由化学方程式N2(g)+3H2(g)?2NH3(g)可知 , A、平衡时各物质的分子数之比取决于物质的起始物质的量和转化率,故A、B、C的分子数之比为1:3:2不能作为判断是否达到平衡状态的依据,错误;B、单位时间内生成amol N2为逆反应,同时生成amolNH3是正反应,化学反应速率之比与化学计量数之比不等,故正逆反应速率不等,故不能说明达到平衡状态,错误;C、每断裂1molN≡N是正反应,同时断裂3molH-H也是正反应,故不能说明达到平衡状态,错误;D、 每生成1mol N≡N是逆反应,同时生成6molN-H是正反应,且化学反应速率之比等于化学计量数之比,故正逆反应速率相等,说明达到平衡状态,正确。
考点:平衡状态的判断,把握两点,一是正逆双向,二是变化量之比等于化学计量数之比。
本题难度:简单
5、填空题 (16分)随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%,CO2的排放量也要大幅减少。
Ⅰ.处理NOx的一种方法是利用甲烷催化还原NOx。
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2
③CH4(g)+2NO2 (g)= N2(g) + CO2(g)+2H2O(g) △H3=-867kJ·mol-1
则△H2= 。
Ⅱ.化石燃料的燃烧、含硫金属矿石的冶炼和硫酸的生产过程中产生的SO2是大气中SO2的主要来源。
(1)将煤转化为水煤气是将煤转化为洁净燃料的方法之一,反应为C(s) + H2O(g)  CO(g) + H2(g)
CO(g) + H2(g)
①该反应的化学平衡常数表达式为:K= 。
②800℃时,将1molCO、3mol H2O、1mol H2充入容积为1L的容器中,发生反应: CO(g) + H2O(g)  CO2(g) + H2(g),一定时间后达到平衡时,测得容器中CO2浓度为0.5mol·L-1,则CO的转化率为_________,800℃时该反应的平衡常数为_________。
CO2(g) + H2(g),一定时间后达到平衡时,测得容器中CO2浓度为0.5mol·L-1,则CO的转化率为_________,800℃时该反应的平衡常数为_________。
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
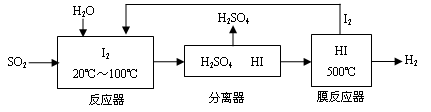
①用离子方程式表示反应器中发生的反应_______________________________________。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是: ___________。
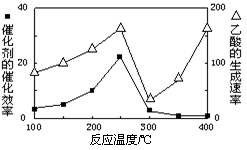
Ⅲ.以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4通过反应CO2(g)+CH4(g) CH3COOH(g)直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率
CH3COOH(g)直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率
如图所示。由下图可以得出的结论是(写两条):_____________________、___________________。
参考答案:Ⅰ.-1160KJ/mol (2分) Ⅱ.(1) ①K=[c
本题解析:
试题分析:Ⅰ.③×2-①,整理可得:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=2△H3-△H1=2×(-867kJ/mol)+574kJ/mol=-1160KJ/mol;Ⅱ.(1)①反应为C(s) + H2O(g)  CO(g) + H2(g) 的化学平衡常数表达式为:
CO(g) + H2(g) 的化学平衡常数表达式为: ;②800℃时,将1molCO、3mol H2O、1mol H2充入容积为1L的容器中,发生反应:[ CO(g) + H2O(g)
;②800℃时,将1molCO、3mol H2O、1mol H2充入容积为1L的容器中,发生反应:[ CO(g) + H2O(g)  CO2(g) + H2(g),一定时间后达到平衡时,测得容器中CO2浓度为0.5mol·L-1,则CO的转化率为
CO2(g) + H2(g),一定时间后达到平衡时,测得容器中CO2浓度为0.5mol·L-1,则CO的转化率为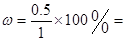 50%,则平衡时各种物质的浓度分别是:c(CO)=0.5mol/L;c(H2O)="2." 5mol/L;c(CO2)=0.5mol/L;c(H2)=1.5mol/L;所以800℃时该反应的平衡常数为
50%,则平衡时各种物质的浓度分别是:c(CO)=0.5mol/L;c(H2O)="2." 5mol/L;c(CO2)=0.5mol/L;c(H2)=1.5mol/L;所以800℃时该反应的平衡常数为 ;(2)①在反应器中SO2、I2、H2O发生氧化还原反应产生硫酸和氢碘酸,用离子方程式表示反应器中发生的反应是SO2+2H2O+I2=4H++SO42-+2I-;②碘化氢分解反应是可逆反应;当从反应体系分离出H2,实质是降低了生成物的浓度,根据平衡移动原理:降低生成物的浓度,平衡正向移动,可以使反应得到的I2再回到反应器中促进SO2的转化吸收;Ⅲ.根据图像可知其它条件不变时,100—250℃之间,温度升高,催化剂的催化效率升高;其它条件不变时,100—250℃之间,温度升高,乙酸的生成速率加快;其它条件不变时,250℃—300℃之间,温度升高,催化剂的催化效率降低;250℃—300℃之间,温度升高,乙酸的生成速率减慢;300℃—400℃之间,温度升高,催化剂的催化效率变化不大;300℃—400℃之间,温度升高,乙酸的生成速率加快;
;(2)①在反应器中SO2、I2、H2O发生氧化还原反应产生硫酸和氢碘酸,用离子方程式表示反应器中发生的反应是SO2+2H2O+I2=4H++SO42-+2I-;②碘化氢分解反应是可逆反应;当从反应体系分离出H2,实质是降低了生成物的浓度,根据平衡移动原理:降低生成物的浓度,平衡正向移动,可以使反应得到的I2再回到反应器中促进SO2的转化吸收;Ⅲ.根据图像可知其它条件不变时,100—250℃之间,温度升高,催化剂的催化效率升高;其它条件不变时,100—250℃之间,温度升高,乙酸的生成速率加快;其它条件不变时,250℃—300℃之间,温度升高,催化剂的催化效率降低;250℃—300℃之间,温度升高,乙酸的生成速率减慢;300℃—400℃之间,温度升高,催化剂的催化效率变化不大;300℃—400℃之间,温度升高,乙酸的生成速率加快;
考点:考查盖斯定律的应用、化学平衡常数和物质的平衡转化率的计算、外界条件对平衡的影响、图像法在化学反应平衡移动中的作用、离子方程式的书写的知识。
本题难度:困难