微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各溶液中,Na+浓度最大的是
A.5 L 1.2 mol·L-1的Na2SO4溶液
B.2 L 0.8 mol·L-1的NaOH溶液
C.1 L 1 mol·L-1的Na2CO3溶液
D.4 L 0.5 mol·L-1的NaCl溶液
参考答案:A
本题解析:
试题分析:A中1.2 mol·L-1的Na2SO4溶液中Na+浓度是2.4mol/L,B中0.8 mol·L-1的NaOH溶液中Na+浓度是0.8mol/L,C中1 mol·L-1的Na2CO3溶液中Na+浓度是2mol/L,D中0.5 mol·L-1的NaCl溶液中Na+浓度是是0.5mol/L,所以四种溶液中,Na+浓度最大的是2.4mol/L,答案选A。
考点:考查离子浓度与溶液浓度之间的关系
本题难度:一般
2、计算题 现有NaOH和Na2CO3固体混合物18.6g ,加入足量2mol/L 的盐酸,放出标准状况下的气体2.24L,则原固体混合物中NaOH和Na2CO3的物质的量各为多少?反应后溶液加水至500mL,则溶液中Na+的物质的量浓度为多少?
参考答案:NaOH 0.2mol &
本题解析:
试题分析:NaOH和Na2CO3固体混合物中加入足量2mol/L 的盐酸,放出标准状况下的气体2.24L,该气体为二氧化碳,生成的二氧化碳的物质的量为: =0.1mol,根据C原子守恒,则碳酸钠的物质的量为0.1mol;0.1mol碳酸钠的质量为:106g/mol×0.1mol=10.6g,则混合物中氢氧化钠的物质的量为:
=0.1mol,根据C原子守恒,则碳酸钠的物质的量为0.1mol;0.1mol碳酸钠的质量为:106g/mol×0.1mol=10.6g,则混合物中氢氧化钠的物质的量为: =0.2mol;根据钠离子守恒可知,溶液中含有钠离子的物质的量为:0.1mol×2+0.2mol=0.4mol,则溶液中Na+的物质的量浓度为:0.4mol0.5L=0.8mol/L,答:原固体混合物中NaOH和Na2CO3的物质的量分别为0.2mol、0.1mol;溶液中Na+的物质的量浓度为0.8mol/L.
=0.2mol;根据钠离子守恒可知,溶液中含有钠离子的物质的量为:0.1mol×2+0.2mol=0.4mol,则溶液中Na+的物质的量浓度为:0.4mol0.5L=0.8mol/L,答:原固体混合物中NaOH和Na2CO3的物质的量分别为0.2mol、0.1mol;溶液中Na+的物质的量浓度为0.8mol/L.
考点:考查有关混合物反应的计算。
本题难度:一般
3、选择题 下列叙述中,正确的是

A.1 mol 乙醇分子中含有的共价键数为7×6.02×1023

B.1 mol甲基(-CH3)中含有的电子数为10×6.02×1023

C.14 g乙烯和丙烯的混合物中含有的碳原子数为1×6.02×1023
D.28 g C16O与28 g C18O中含有的质子数均为14×6.02×1023
参考答案:C
本题解析:略
本题难度:一般
4、选择题 已知a g气体X2中含有b个X原子,那么c g该气体在0℃、1.01×105 Pa条件下的体积是(NA表示阿伏加德罗常数的值)
A.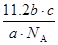 L
L
B.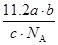 L
L
C.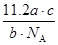 L
L
D.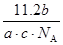 L
L
参考答案:A
本题解析:a g气体X2中含有b个X原子,该物质的相对分子质量是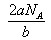 ,所以c g该气体在0℃、1.01×105 Pa条件下的体积是
,所以c g该气体在0℃、1.01×105 Pa条件下的体积是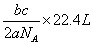
本题难度:一般
5、选择题 在硫酸铝、硫酸钾和明矾的混合溶液中,c(SO42-)=0.4mol/L,当加入等体积0.4mol/L KOH溶液时,生成的沉淀恰好完全溶解。则反应后溶液中K+的浓度约为
A.0.225mol/L
B.0.25mol/L
C.0.45mol/L
D.0.9mol/L
参考答案:C
本题解析:
试题分析:硫酸铝、硫酸钾和明矾的混合溶液实际为硫酸铝、硫酸钾的混合溶液,加入等体积0.4mol/L KOH溶液时,生成的沉淀恰好完全溶解,发生反应Al3++4OH-=AlO2-+2H2O,根据方程式可知,n(Al3+)=1/4n(OH-),所以原溶液中c(Al3+)=1/4c(OH-)=1/4×0.4mol/L=0.1mol/L,根据溶液呈电中性可知,原混合溶液中3c(Al3+)+c(K+)=2c(SO42-),所以c(K+)=2c(SO42-)-3c(Al3+)=2×0.4mol/L-3×0.1mol/L=0.9mol/L,混合后的体积为原来的2倍,钾离子来源于原混合溶液及氢氧化钾溶液,反应后溶液中K+离子的浓度为1/2×(0.9mol/L)=0.45mol/L,选C。
考点:考查离子方程式的有关计算。
本题难度:一般