微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组溶液中,各离子能大量共存的是
A.滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、I-
B.pH为1的溶液:Cu2+、Na+、NO3-、SO42-
C.水电离出来的c(H+)=10-13mol/L的溶液:K+、Ba2+、HCO3-、Br-
D.溶质为Na2SO4的溶液:K+、Al3+、CO32-、NO3-
参考答案:B
本题解析:试题分析:A中Fe3+氧化I-,不能共存;B可以;C中溶液水电离出来的c(H+)=10-13mol/L,可以推出溶液为酸性或碱性,HCO3-不能大量共存;D中Al3+与CO32-双水解不能共存
考点:考查基本理论,离子共存
本题难度:一般
2、选择题 不能用有关胶体的观点解释的现象是
A.在河流入海口易形成三角洲
B.同一钢笔同时使用不同牌号的墨水易发生堵塞
C.在NaCl溶液中滴入AgNO3溶液有沉淀
D.在实验中不慎手被玻璃划破,可用FeCl3溶液应急止血
参考答案:C
本题解析:A、B、D都属于胶体的聚沉;C是因为反应生成了AgCl沉淀。
本题难度:一般
3、填空题 (8分)
(1)写出下列反应的离子方程式
①Ca(HCO3)2与过量的NaOH溶液的反应:
②CH3COOH溶液与NaOH溶液反应:
(2)写出下列反应的离子方程式,并在离子方程式中用“单线桥”表示电子转移的方向和数目:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
如果此反应生成了5molCl2,发生氧化反应的HCl的物质的量为 mol。
参考答案:(1)①Ca2++2HCO3-+2OH-=CaCO3↓+2H
本题解析:
试题分析:(1)①Ca(HCO3)2与过量的NaOH溶液的反应的离子反应为Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-,故答案为:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-;②CH3COOH溶液与NaOH溶液反应的离子反应为CH3COOH+OH-=CH3COO-+H2O,故答案为:CH3COOH+OH-=CH3COO-+H2O.(2)根据离子方程式的书写方法,得到反应的离子方程式为:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O,应的氧化剂是高锰酸钾,还原剂是盐酸,在反应的16mol盐酸中,只有10mol做还原剂,被氧化、发生氧化反应,同时转移电子是10mol,用单线桥表示反应中电子转移的方向和数目为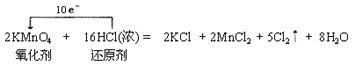 ,此反应生成了5molCl2,发生氧化反应的HCl的物质的量为10mol,故答案为:
,此反应生成了5molCl2,发生氧化反应的HCl的物质的量为10mol,故答案为:
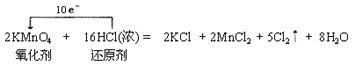 2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;10.
2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;10.
考点:离子反应方程式书写、氧化还原反应
本题难度:一般
4、选择题 已知:2FeCl3?+?2KI?=?2FeCl2?+?2KCl?+?I2,2FeCl2?+?Cl2?=?2FeCl3,由此判断,下列物质的氧化能力由强到弱的顺序正确的是
A.Fe3+ Cl2 I2
B.Cl2 Fe3+ I2
C.I2 Cl2 Fe3+
D.Cl2 I2 Fe3+
参考答案:B
本题解析:
正确答案:B
在反应中氧化剂的氧化性大于氧化产物,由前一个反应,氧化性:Fe3+ >I2,由后一个反应,氧化性:Cl2? >Fe3+,综合后Cl2 > Fe3+ > I2
本题难度:一般
5、选择题 已知氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1?mol氢气中的化学键消耗的能量为Q1KJ,破坏1?mol氯气中的化学键消耗的能量为Q2KJ,形成1?mol氯化氢中的化学键释放的能量为Q3KJ,则下列关系式中一定正确的是
A.Q1+Q2<2Q3
B.Q1+Q2>2Q3
C.Q1+Q2<Q3
D.Q1+Q2=Q3
参考答案:A
本题解析:氢气燃烧是放热反应,△H小于0。而反应热就是断键吸收的能量与形成化学键所放出的能量的差值,所以Q1+Q2-2Q3=△H<0,选项A正确,答案选A。
本题难度:简单