微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 如图是实验室制SO2并验证SO2某些性质的装置图.
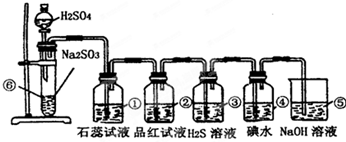
试回答:
(1)①中的实验现象是______,此实验证明SO2是______性气体.
(2)②中的品红溶液______,证明SO2有______性.
(3)③中的实验现象是______,证明SO2有______性.化学反应方程式______
(4)④中的实验现象是______,证明SO2有______性.化学反应方程式______
(5)⑤中的作用是______,反应的化学方程式是______.
参考答案:(1)①二氧化硫与水反应生成亚硫酸,遇石蕊变红,则实验现象变
本题解析:
本题难度:一般
2、填空题 (1)现有废铜屑和废硫酸,请从原料的利用率和环保的角度分析,设计一个制取胆矾(CuSO4?5H2O)的合理方案,只用化学方程式说明
第一步:______
第二步:______
第三步:过滤,加热浓缩,冷却结晶______
(2)有人建议用铜和稀硫酸混合在加热的条件下不断通入空气以制得硫酸铜溶液,请写出该反应的化学方程式______.
参考答案:(1)以废铜屑和废硫酸为原料,从原料的利用率和环保的角度分析
本题解析:
本题难度:一般
3、实验题 针对苏教版化学I第75页上“铁与氧化性较弱的氧化剂(如盐酸、硫酸铜溶液等)反应转化为+2价铁的化合物,如果与氧化性较强的氧化剂(如氯气、双氧水等)反应则转化为+3价的化合物”的叙述,化学研究性学习小组拟通过以下实验探究“新制的还原性铁粉和盐酸的反应(铁过量)”。请你参与探究并回答有关问题:
(1)通过简单的化学实验检验反应后混合物中的二价铁的实验方法和现象是____________________;但在实验中往往又看到血红色迅速褪去,同时溶液呈黄色,其可能的原因是:___________________;学生在做实验时往往滴加双氧水的浓度过大,或者过量,还看到迅速产生大量气泡,写出产生该现象的化学方程式:____________________。
(2)有资料介绍“取少量反应液(含二价铁)先滴加少量新制饱和氯水,然后滴加KSCN溶液,呈现血红色。若再滴加过量新制氯水,却发现血红色褪去。同学对血红色褪去的原因提出各自的假设。某同学的假设是:溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式____________________。
(3)探究高铁酸钾的某种性质。
【实验1】将适量K2Fe来源:91考试网O4固体分别溶解于pH为4.74、7.00、11.50的水溶液中,配得FeO42-浓度为1.0
mmol·L-1(1 mmol·L-1 =10-3 mol·L-1)的试样,静置,考察不同初始 pH的水溶液对K2FeO4某种性质的影响,结果见图1(注:800 min后,三种溶液中高铁酸钾的浓度不再改变)。?

【实验2】将适量K2FeO4溶解于pH=4.74 的水溶液中,配制成FeO42-浓度为1.0 mmol·L-1 的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2。则
①实验1的目的是_______________;
②实验2可得出的结论是_______________;
③高铁酸钾在水中的反应为4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2↑。由图1可知,800min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是________________。
4Fe(OH)3+8OH-+3O2↑。由图1可知,800min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是________________。
参考答案:(1)先加硫氰化钾溶液,无现象,再滴加双氧水少许,看到溶液呈
本题解析:
本题难度:困难
4、实验题 已除去泥沙的粗盐中,仍含有Mg2+、Ca2+和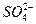 ,请填写下表中的空格,完成将粗盐提纯,得到氯化钠晶体的实验设计。
,请填写下表中的空格,完成将粗盐提纯,得到氯化钠晶体的实验设计。
①
| 溶解
| 将粗盐放入烧杯中,加入适量的蒸馏水,充分搅拌,直至固体全部溶解
|
②
| 沉淀
| 逐渐加入氢氧化钠溶液,直至不再出现沉淀为止
|
③
| ?
| ?
|
④
| ?
| ?
|
⑤
| 过滤
| 安装好过滤器,将④烧杯中的悬浊液沿玻璃棒加入过滤器中过滤
|
⑥
| ?
| ?
|
⑦
| ?
| ?
实验目的:粗盐提纯,得到纯净氯化钠晶体
实验用品:(1)药品:粗盐、NaOH溶液、HCl溶液、Na2CO3溶液、BaCl2溶液、pH试纸和蒸馏水。
(2)仪器:略
(不必叙述如何组装实验装置)实验问题讨论
(1)甲同学在多次过滤后,发现烧杯中的滤液仍浑浊,分析他的操作不当的原因可能是:
①_______________________________________________________________________。
②______________________________________________________________________。
(2)乙同学过滤后,滤液是澄清的,当取少量蒸发后的氯化钠晶体溶于水滴加硫酸钠溶液时,却出现白色沉淀。分析乙在实验步骤设计上存在的问题可能是____________________。
参考答案:
③
沉淀
逐渐加入氯化钡溶液,直至不再出
本题解析:此题考查物质分离和提纯的同时考查了实验设计和评价能力及对实验结果的分析能力。除去粗盐中的Mg2+、Ca2+和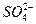 可分别用NaOH、Na2CO3、BaCl2溶液,为了保证除干净,试剂均应过量。加入Na2CO3产生的新杂质离子 可分别用NaOH、Na2CO3、BaCl2溶液,为了保证除干净,试剂均应过量。加入Na2CO3产生的新杂质离子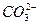 用盐酸除去;加入BaCl2产生的新杂质离子Ba2+用Na2CO3除去,所以Na2CO3应当放在BaCl2之后加入。若二者的顺序颠倒就会出现乙同学的结果。过滤时应注意漏斗中悬浊液的液面要低于滤纸边缘,否则会使所得滤液浑浊。玻璃棒要靠在三层滤纸处,以防玻璃棒捅破滤纸,否则也会使滤液浑浊,得到甲同学一样的实验结果。 用盐酸除去;加入BaCl2产生的新杂质离子Ba2+用Na2CO3除去,所以Na2CO3应当放在BaCl2之后加入。若二者的顺序颠倒就会出现乙同学的结果。过滤时应注意漏斗中悬浊液的液面要低于滤纸边缘,否则会使所得滤液浑浊。玻璃棒要靠在三层滤纸处,以防玻璃棒捅破滤纸,否则也会使滤液浑浊,得到甲同学一样的实验结果。
本题难度:简单
5、简答题 某学生取纯净的Na2SO3?7H2O?50.00g,在密闭容器中经6000C以上的强热至恒重,分析及计算表明,恒重后的样品质量相当于无水亚硫酸钠的计算值,而且各元素的组成也符合计算值,但将它溶于水,却发现溶液的碱性大大高于同时配制的亚硫酸钠溶液.经过他的实验和思考,这位同学解释了这种反常现象.
(1)他将恒重后的样品溶于水配成溶液,为加速溶解,可采取______的措施,观察发现样品全部溶解,溶液澄清.
(2)取少量(1)中所配溶液,加入足量的用______?(填一种酸)酸化的氯化钡溶液有白色沉淀,说明产物中含有______(填离子符号).
(3)另取少量(1)中所配溶液于试管中,滴加少量盐酸,看到气泡产生,通过______方法闻到臭鸡蛋气味,说明生成______气体,写出生成该气体的离子反应方程式:______;同时发现溶液变浑浊,原因是:(用离子方程式表示)______.
(4)根据以上实验,该同学经分析解释了以上实验中的反常现象,请你用一个化学方程式表示:______.这一反应在上述实验中______(填“是”或“否”)能确定反应完全.
参考答案:(1)加速固体的溶解,可用搅拌或加热的方法,故答案为:搅拌或
本题解析:
本题难度:一般
|