微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 利用钠碱循环法可脱除烟气中的SO2。在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得。当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
下列有关上述过程的说法错误的是
A.NaOH溶液吸收SO2制得Na2SO3溶液的离子方程式:2OH-+SO2=SO32-+H2O
B.当吸收液呈中性时,溶液中的离子浓度满足:c(Na+)=2c(SO32-)+c(HSO3-)
C.吸收液吸收SO2的过程中,pH与 的大小成反比
的大小成反比
D.HSO3-在阳极放电时的电极反应式:HSO3-+H2O-2e-=S042- +3H+
参考答案:C
本题解析:
试题分析:A、SO2是酸性氧化物,能和氢氧化钠溶液反应生成亚硫酸钠,反应的离子方程式是2OH-+SO2=SO32-+H2O,A正确;B、根据电荷守恒可知,c(Na+) +c(H+)= c(OH-) +2c(SO32-)+c(HSO3-)。当吸收液呈中性时, c(H+)= c(OH-),所以c(Na+)=2c(SO32-)+c(HSO3-),B正确;C、当
本题难度:一般
2、选择题 常温下,下列各组离子在指定溶液中可能大量共存的是:
A.滴入甲基橙显红色的溶液中: Na+、NO3ˉ、 Fe2+、SO32ˉ
B.水电离出的 c ( H+) = 10ˉ12 mol/L 的溶液中:K+、 AlO2ˉ、 CH3COOˉ、 Clˉ
C.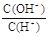 =10ˉ12的溶液中: K+、ClOˉ、S2ˉ、 Clˉ
=10ˉ12的溶液中: K+、ClOˉ、S2ˉ、 Clˉ
D.c ( Fe 3+ ) =" 0" .1 mol/L 的溶液中: K+、Clˉ 、SO42ˉ、 SCNˉ
参考答案:B
本题解析:
试题分析:A.滴入甲基橙显红色,溶液为酸性: NO3ˉ与Fe2+、SO32ˉ不大量共存;B.水电离出的c(H+)=10ˉ12 mol/L的溶液可以为酸性,AlO2ˉ和CH3COOˉ不能大量共存,可以为碱性,可以大量共存;C.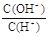 =10ˉ12溶液的c(H+)=10-1mol/L,即酸性溶液:ClOˉ与S2ˉ发
=10ˉ12溶液的c(H+)=10-1mol/L,即酸性溶液:ClOˉ与S2ˉ发
本题难度:一般
3、选择题 下列各微粒在溶液中可大量共存的是[???? ]
A. H+、K+、OH-、SO42-
B. Mg2+、K+、Cl-、NO3-
C. Cu2+、Ba2+、OH-、Cl-
D. Cl2、Na+、Fe2+、OH-
参考答案:B
本题解析:
本题难度:一般
4、选择题 常温下,某溶液中由水电离产生的c(H+)、c(OH-)满足c(H+)·c(OH-)=10-24,则下列各组离子在该溶液中可能大量共存的是
A.NH4+、Fe2+、NO3-、SO42-
B.Ba2+ 、Na+、Cl-、NO3-
C.Na+、Cl-、SO42-、HCO3-
D.K+、Na+、AlO2-、Cl-
参考答案:BD
本题解析:
正确答案:B D
由水电离产生的c(H+)、c(OH-)满足c(H+)·c(OH-)=10-24,说明抑制水电离,是酸或碱溶液,A、酸性时,3Fe2++4H++NO3―=3Fe3++NO+2H2O,碱性时,NH4+、Fe2+与OH―不共存
C、HCO3-无论在酸性或碱性条件下均不大量存在。
本题难度:一般
5、选择题 常温下,用0.10 mol·L-1 KOH溶液滴定10.00 mL 0.10 mol·L-1H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。下列说法正确的是
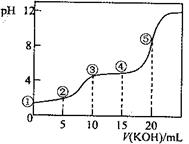
A.点①所示溶液中: c(H+)/c(OH—)=1012
B.点②所示溶液中: c(K+)+c(H+)=c(HC2O4—)+c(C2O42-)+c(OH—)
C.点③所示溶液中:c(K+)>c(HC2O4—)> c(H2C2O4)>c(C2O42-)
D.点④所示溶液中:c(K+)+ c(H2C2O4)+ c(HC2O4—) +c(C2O42-)=0.10mol·L-1
参考答案:D
本题解析:c(H+)/c(OH—)=1012,则氢离子浓度是0.10mol/L,但草酸是弱酸,0.10mol/L的草酸溶液 中氢离子浓度可能是0.10mol/L,A不正确。B不正确,不符合电荷守恒定律。点③所示溶液显酸性,说明HC2O4—的电离程度大于其水解程度,所以应该是c(K+)>c(HC2O4—)>c(C2O42-)> c(H2C2O4),C不正确。D正确,符合物料守恒,答案选D。
本题难度:简单