微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 有些离子方程式能表示一类反应,有些离子方程式却只能表示一个反应。下列离子方程式中,只能表示一个化学反应的是
① Fe+Cu2+===Fe2++Cu ② Ba2++2OH-+2H++SO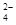 ===BaSO4↓+2H2O
===BaSO4↓+2H2O
③ Cl2+H2O===H++Cl-+HClO ④ CO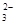 +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
⑤ Ag++Cl-===AgCl↓
A.只有③
B.②③
C.③⑤
D.①④
参考答案:A
本题解析:
试题分析:③的离子反应中反应物均为分子(Cl2、H2O),只能代表一个反应即Cl2+H2O===HCl+HClO。
考点:考查离子反应。
本题难度:一般
2、选择题 下列各组试剂在溶液中反应,当两种试剂的量发生改变时,不能用同一离子方程式表示的是 ( )
A.氢氧化钠和硫酸铝
B.氢氧化钠和氯化镁
C.硫酸钠和氧氧化钡
D.氯化铝和氨水
参考答案:A
本题解析:略
本题难度:一般
3、填空题 (10分)现有五种溶液,分别含下列离子:①Ag+,②Mg2+,③Fe2+,④Al3+,⑤Fe3+。
(1)写出符合下列条件的离子符号:既能被氧化又能被还原的离子是 ,遇KSCN溶液显血红色的是 ,加铁粉后溶液增重的是 ;
(2)向③的溶液中滴加NaOH溶液,现象是 ,写出此步操作属于氧化还原反应的化学方程式 。
参考答案:(1)Fe2+,Fe3+,Fe3+; (2)生成白
本题解析:
试题分析:Fe2+化合价为+2价,既能够失电子,也能够得电子,Fe3+能用KSCN溶液检验,向上述溶液中加入铁粉,发生Fe+2Ag+=Fe2++ 2Ag,溶液质量减轻,Fe+2Fe3+=3Fe2+,溶液质量增重,所以既能被氧化又能被还原的离子是Fe2+,遇KSCN溶液显血红色的是Fe3+,加铁粉后溶液增重的是Fe3+;
(2)Fe2++2OH-=Fe(OH)2 ↓(白色沉淀)、4Fe(OH)2+O2+2H2O=4Fe(OH)3,所以向Fe2+的溶液中滴加NaOH溶液,现象是生成白色絮状沉淀,迅速变为灰绿色,最后变为红褐色沉淀。
考点:考查铁及离子的性质。
本题难度:一般
4、选择题 下列离子方程式与所述事实相符且正确的是 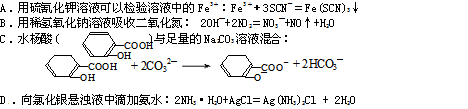
参考答案:C
本题解析:A.产物为络合物,并非沉淀:Fe3++3SCN-=Fe(SCN)3
B.两边电荷不相等,产物不正确:2NO2+2OH-=NO3-+NO2-+H2O
C.正确;
D.银氨络离子应该拆开:AgCl+2NH3·H2O=Ag(NH3)2++Cl-+2H2O
本题难度:一般
5、填空题 2g Cu2S和CuS的混合物在酸性溶液中用400mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350mL 0.1mol/L(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
MnO4-+ Fe2++ H+= Mn2++ Fe3++H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为 mol。
(3)欲配制500mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为 g。
(4)混合物中Cu2S的质量分数为 。
参考答案:(1)1、5、8、1、5、4
(2)0.007
本题解析:
试题分析:(2)设消耗高锰酸钾xmol,
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
1mol 5mol
xmol 0.350L×0.1mol/L
所以x=0.007。剩余KMnO4的物质的量为0.007mol。
(3)设(NH4)2Fe(SO4)2?6H2O 的物质的量为ymol,
(NH4)2Fe(SO4)2?6H2O---- Fe2+
1mol 1mol
ymol 0.500L×0.1mol/L
y=0.05,
所以其质量为m=nM=0.05mol×392g/mol=19.6g;
故答案为:19.6g。
(4)设Cu2S的物质的量为mmol,CuS的物质的量为nmol,
8MnO4-+44H++5Cu2S=10Cu2++5SO2+8Mn2++22H2O
8 5
8m/5mol mmol
6MnO4-+28H++5CuS=5Cu2++5SO2+6Mn2++14H2O
6 5
6n/5mol nmol
所以列方程组为:160mg+96ng=2g,8m/5mo+6n/5mol,解得m=0.005,n=0.0125。
所以Cu2S的质量为0.8g,CuS的质量为1.2g,
Cu2S的质量分数为0.8g÷2g×100%=40%,
故答案为:40%
考点:离子方程式的有关计算
点评:本题考查了离子方程式的有关计算,难度较大,易错题是(2),注意铵根离子和(NH4)2Fe(SO4)2的关系式,根据铵根离子计算(NH4)2Fe(SO4)2的质量。
本题难度:一般