微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式书写正确的是 ( )
A.稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑
B.氢氧化镁与硫酸溶液反应OH-+H+= H2O
C.氢氧化钡溶液与稀硫酸的反应Ba2+ + OH-+ H+ + SO42-=BaSO4↓ + H2O
D.将金属Cu加入FeCl3溶液中:2Fe3+ + Cu=2Fe2+ + Cu2+
参考答案:D
本题解析:
试题分析:铜不活泼,不能与稀硫酸不反应,A错误;氢氧化镁难溶于水,不能拆成离子形式,应该写成分子式的形式,B错误;氢氧化钡与硫酸的反应不符合物质固定的组成,正确写法为Ba2+ + 2OH-+ 2H+ + SO42-=BaSO4↓ +2 H2O,C错误;铜与三价铁离子发生氧化还原反应,D正确,答案选D.
考点:离子方程式的书写
本题难度:一般
2、选择题 下列反应能用CO32- + 2H+ = CO2 ↑ + H2O表示的是
A.Na2CO3 + H2SO4= Na2SO4+ CO2 ↑ + H2O
B.CaCO3 + 2HCl =CaCl2 + CO2 ↑+ H2O
C.KHCO3 + HCl =" KCl" + CO2 ↑ + H2O
D.BaCO3 + 2HNO3 =Ba(NO3 )2+ CO2 ↑ + H2O
参考答案:A
本题解析:
试题分析:除了A以外,其他的离子方程式表示如下:B.CaCO3 + 2H+ =Ca2+ + CO2 ↑+ H2O;C.HCO3-+ H+ = CO2 ↑ + H2O;D.BaCO3 + 2H+=Ba2+ + CO2 ↑ + H2O;答案选A。
考点:考查离子方程式的意义。
本题难度:一般
3、填空题 (12分)(1)环境专家认为可以用金属铝将水体中的NO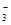 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH
转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH 、Al(OH)3、NO
、Al(OH)3、NO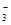 、N2,写出反应的离子方程式 。
、N2,写出反应的离子方程式 。
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应为:4Al+3O2+6H2O=4Al(OH)3。电池正极的电极反应式为 。
(3)已知:4Al(s)+3O2(g)=2Al2O3(g) △H=-2834.9kJ/mol
Fe2O3(s)+ C(s)=
C(s)=  CO2(g)+2Fe(s) △H=+234.1kJ/mol
CO2(g)+2Fe(s) △H=+234.1kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
写出铝与氧化铁发生铝热反应的热化学方程式 。
(4)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mol,pH=14的溶液,然后2mol/L盐酸滴定,可得沉淀质量与消耗的盐酸体积关系如下图:则反应过程中产生氢气的总体积为 L(标准状况)

参考答案:(每空3分)(1)6NO3-+10Al+18H2O=10Al
本题解析:
试题分析:(1)由金属铝将水体中的NO3-转化为N2可知,反应中Al元素被氧化,化合价由0价升高到+3价;N元素被还原,化合价从+5价降低到0价,则根据电子得失守恒可知反应的离子方程式为6NO3-+10Al+18H2O=10Al(OH)3+3N2↑+6OH-;
(2)由电池总反应4Al+3O2+6H2O=4Al(OH)3可知,Al作负极,氧气在正极上得电子发生还原反应,正极反应为2H2O+O2+4e-=4OH-;
(3)由①4Al(s)+3O2(g)=2Al2O3(g)△H=-2834.9kJ/mol,②Fe2O3(s)+ C(s)=
C(s)= CO2(g)+2Fe(s)△H=+234.1kJ/mol,③C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol,根据盖斯定律可知,①×
CO2(g)+2Fe(s)△H=+234.1kJ/mol,③C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol,根据盖斯定律可知,①× +②-③×
+②-③× 可得,2Al(s)+Fe2O3(s)=2Fe(s)=2Fe(s)+Al2O3(s)△H=-593.1kJ/mol;
可得,2Al(s)+Fe2O3(s)=2Fe(s)=2Fe(s)+Al2O3(s)△H=-593.1kJ/mol;
(4)由2Na+2H2O
本题难度:一般
4、填空题 (本小题共4分)离子反应是中学化学中重要的反应类型。回答下列问题:
(1)离子方程式是重要的化学用语。下列是有关离子反应的一些错误观点,请在下列表格中用相应的一个“离子方程式”否定这些观点。(不能相同)
①强酸与强碱发生中和反应均可表示为:H++OH-=H2O
|
|
②强酸与碱混合一定发生中和反应
|
参考答案:(2) ①如Ba2++2OH-+2H++SO===BaSO4
本题解析:
试题分析:①强酸与强碱发生中和反应,若产物是可溶性盐,可表示为:H++OH-=H2O;若是难溶性盐,则不能表示为上述式子,如硫酸与氢氧化钡的反应离子方程式是Ba2++2OH-+2H++SO===BaSO4↓+2H2O;②强酸与碱混合可能发生中和反应,也可能发生氧化还原反应,如硝酸与氢氧化亚铁的反应,表示为3Fe(OH)2 + 10H+ + NO3-==3Fe3+ + NO↑+ 8H2O。
考点:考查离子方程式表示的含义的一般规律及特殊性的知识。
本题难度:一般
5、填空题 某溶液中含有Ba2+、Cu2+和Ag+,现用氢氧化钠、盐酸和硫酸钠溶液将三种离子逐一沉淀分离。其流程如下图所示:(其中“溶液2”为无色溶液)
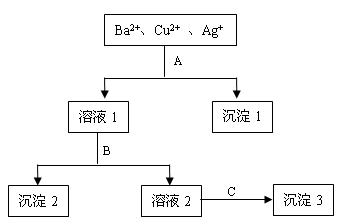
回答下列问题:
(1)沉淀1 的化学式: 。 的化学式: 。
(2)写出下列反应的离子方程式:
溶液1 + B: 。
溶液2 + C: 。 C: 。
参考答案:(1)AgCl(2分)
(2)Cu2+ + 2OH-
本题解析:略
本题难度:一般
|