Mr(100+S)?
1000Sρ
mol?L-1
参考答案:相对分子质量为Mr的某物质在室温下的溶解度为S?g,此时测得
本题解析:
本题难度:简单
2、选择题 下列叙述正确的是
A.48g O3气体含有6.02×1023个O3分子
B.5.6g Fe与足量的稀盐酸反应转移电子0.3 mol
C.0.5mol·L-1CuCl2溶液中含有3.01×1023个Cu2+
D.标准状况下,33.6LH2O含有9.03×1023个H2O分子
参考答案:A
本题解析:
试题分析:A、48g O3物质的量为:48g÷48g/mol=1mol,所以O3分子数目为6.02×1023:,故A正确;B、Fe与盐酸反应生成FeCl2,Fe失去2e?,所以5.6g Fe与足量的稀盐酸反应转移电子0.2 mol,故B错误;C、没有给出溶液的体积,无法求算离子数目,故C错误;D、标准状况下,H2O不是气体,不能用22.4L/mol进行换算,故D错误。
考点:本题考查物质的量的相关计算。
本题难度:一般
3、选择题 质量相同的氧气和二氧化碳中所含原子个数之比为
A.11:8
B.11:12
C.1:1
D.3:2
参考答案:B
本题解析:
试题分析:设质量都为mg,n(O2)=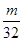 mol,n(CO2)= mol,n(CO2)=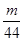 mol,由n= mol,由n=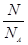 可知,物质的原子个数和物质的量成正比,则氧气和二氧化碳中所含原子个数之比为 可知,物质的原子个数和物质的量成正比,则氧气和二氧化碳中所含原子个数之比为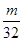 mol×2: mol×2: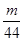 mol×3=11:12,答案选B。 mol×3=11:12,答案选B。
考点:考查物质的量的计算。
本题难度:一般
4、选择题 把一块镁铝合金投入到1mol/L盐酸中,待合金完全溶解后,再往溶液里加入1mol/LNaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积的变化如图所示。下列说法中错误的是
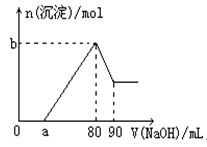
A.盐酸的体积为80mL
B.a的取值范围为0<a<50
C.n(Mg2+)<0.025mol
D.当a值为30时,b值为0.01
参考答案:D
本题解析:根据图像可知,加入氢氧化钠后并没有立即产生沉淀,说明盐酸是过量的,加入的氢氧化钠首先是中和过量的盐酸,当盐酸被中和之后,继续加入氢氧化钠,开始产生氢氧化镁和氢氧化铝沉淀。当沉淀不再发生变化时,继续加入氢氧化钠,此时氢氧化铝开始溶解,直至沉淀不再变化为止。根据图像可知,当沉淀达到最大值时,溶液恰好是氯化钠溶液,根据原子守恒可知氯化钠的物质的量就是加入的氢氧化钠的物质的量,即1mol/L×0.08L=0.08mol,所以盐酸的体积是 本题难度:一般 本题难度:一般
5、选择题 下列叙述中正确的是(?????)
A.任何条件下,等物质的量的水和一氧化碳所含有的分子数必相等
B.同温同压下,相同体积的物质,它们的物质的量必相等
C.1L一氧化碳气体一定比1L氧气的质量小
D.1mol任何气体所占的体积都约为22.4L
参考答案:A
本题解析:由N=n×NA,得A正确;同温同压下,相同体积的气体,物质的量相等,故B错误;
m=V/Vm×M,题中未指明所处的温度、压强,则无法比较,故C错误;
在标准状况下,D正确;
本题难度:一般
|