微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (4分)写出下列物质的电离方程式:
(1)NaHSO4溶于水_______________________________________________________
(2) H2S的电离________________________________________________________
参考答案:(4分) (1)? NaHSO4 = Na++H++SO42
本题解析:略
本题难度:简单
2、选择题 下列图示与对应的叙述相符的是
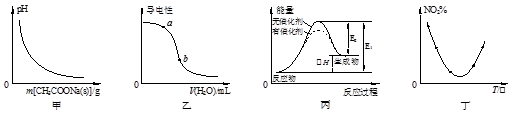
A.图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B.图乙表示向醋酸溶液中加水时其导电性变化,则CH3COOH溶液的pH:a>b
C.图丙表示催化剂能改变化学反应的焓变
D.图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2 (g) N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
参考答案:D
本题解析:
试题分析:A、向CH3COOH溶液中逐步加入CH3COONa固体,因为醋酸根离子浓度增大,所以醋酸的电离平衡逆向移动,pH增大,错误;B、醋酸的稀释过程中,氢离子浓度、醋酸根离子浓度均减小,导电性降低,pH增大,所以b>a,错误;C、催化剂只能改变活化能,不能改变反应热,所以丙图表示催化剂改变反应的活化能,错误;D、二氧化氮的含量最低时说明反应达到平衡状态,再升高温度,二氧化氮的含量增大,说明平衡逆向移动,则正反应是放热反应,则△H<0,正确,答案选D。
考点:考查对化学图像的分析,涉及盐的水解、弱电解质的电离、反应活化能、平衡的移动
本题难度:困难
3、选择题 下列关于弱电解质的说法正确的是( )
A.弱电解质的相对强弱可由相同温度下的电离常数值的大小来判断
B.同一弱电解质,浓度越大,电离程度越大
C.升高温度,弱电解质的电离程度减小
D.通常,电解质越弱,则其溶液的导电能力就越差
参考答案:A.相同温度下,弱电解质的电离平衡常数越大,其电离程度越大,
本题解析:
本题难度:简单
4、选择题 有PH分别为8、9、10的三种相同物质的量浓度的盐溶液NaX、NaY、NaZ,以下说法中不正确的是[???? ]
A.在三种酸HX、HY、HZ中以HX酸性相对最强
B.HX、HY、HZ三者均为弱酸
C.在X-、Y-、Z-三者中,以Z-最易发生水解
D.中和1molHY酸,需要的NaOH稍小于1mol
参考答案:D
本题解析:
本题难度:一般
5、选择题 常温下,pH=12的氨水中存在以下电离平衡:
NH3·H2O NH4+ +OH-。往其中加入少量0.01 mol·L-1NaOH溶液,保持不变的是(?? )
NH4+ +OH-。往其中加入少量0.01 mol·L-1NaOH溶液,保持不变的是(?? )
A.c(NH4+)
B.c(OH-)
C.c(NH3·H2O)
D.c(NH4+)·c(OH-)
参考答案:B
本题解析:pH=12的氨水中c(OH-)=10-2 mol·L-1,故再加入等浓度的NaOH溶液,c(OH-)不会改变;由于溶液体积变大,故c(NH4+)、c(NH3·H2O)、c(NH4+)·c(OH-)都会变小,故A、C、D错误
本题难度:一般