微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图象中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量)? [???? ]
A.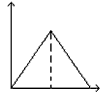
B.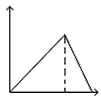
C.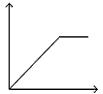
D.
参考答案:D
本题解析:
本题难度:一般
2、选择题 常温下,下列各组离子在指定溶液中一定能大量共存的是
A.c(Fe3+)=0.1 mol·L-1的溶液中:H+、Al3+、Cl-、SCN-
B.pH=12的澄清溶液中:K+、Na+、CO32-、SO42-
C.加入铝粉能产生氢气的溶液中:NH4+、Fe2+、NO3-、SO42-
D.通入足量CO2后的溶液中:Na+、C6H5O-、CH3COO-、HCO3-
参考答案:B
本题解析:
正确答案:B
A.3SCN-+Fe3+="Fe" (SCN)3
B.共存
C.加入铝粉能产生氢气的溶液中:如为碱性,则NH4+、Fe2+与OH―不共存,如为酸性,HNO3与Al不产生H2;
D.通入足量CO2后的溶液中: C6H5O-+H2O+CO2=C6H5OH+HCO3-
本题难度:一般
3、选择题 下列各组离子一定能大量共存的是??????????
A.在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
B.在强碱性溶液中:Na+、K+、Al(OH)4-、CO32-
C.在碱性溶液中:NH4+、Al3+、SO42-、NO3-
D.常温下在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
参考答案:B
本题解析:试题分析:A项Fe3+与SCN-不能大量共存,C项碱性溶液中NH4+、Al3+不能大量共存,D项在酸性溶液中Fe2+、NO3-不能大量共存。答案选B。
考点:离子共存
点评:离子不能大量共存的一般情况是:(1)能发生复分解反应的离子之间(即生成沉淀,气体,水、弱酸、弱碱等难电离物质);(2)能生成难溶物的离子之间(如:Ca2+和 SO42-;Ag+和 SO42-);(3)能完全水解的离子之间,如多元弱酸和弱碱盐的阴、阳离子(如:Al3+, Fe3+与 CO32-、HCO3-、AlO2-、ClO-,S2-等);(4)能发生氧化还原反应的离子之间(如:Fe 、H+、NO3-;S2-、ClO-;S2-、 Fe3+等);(5)能发生络合反应的离子之间(如 Fe3+和 SCN-);解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可排除 Cu2+、 Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;(4)是“可能”共存,还是“一定”共存等。
本题难度:一般
4、选择题 二氧化碳与NaOH溶液反应生成的盐是
A.只能生成碳酸钠
B.只能生成碳酸氢钠
C.生成不溶于水的沉淀
D.可能是碳酸钠和碳酸氢钠的混合物
参考答案:D
本题解析:如果CO2和NaOH两者反应量不同,可能产生不同产物.
本题难度:困难
5、选择题 往100ml?1mol?L的Al2(SO4)3?溶液中加入100ml?4mol?L?Ba(OH)2溶液,最终得到沉淀的质量是
A.15.6g
B.69.9g
C.93.2g
D.85.5g
参考答案:B
本题解析:分析:向Al2(SO4)3?溶液中加入?Ba(OH)2溶液,先发生反应Al3++3OH-=Al(OH)3↓、Ba2++SO42-=BaSO4↓,若Al3+反应完毕,OH-还有剩余,还发生反应:Al(OH)3+OH-=AlO2-+2H2O,计算Al2(SO4)3?溶液中n(Al3+)、n(SO42-),Ba(OH)2溶液中n(Ba2+)、n(OH-),再结合离子方程式计算.
解答:Al2(SO4)3?溶液中:n(Al3+)=0.1L×1mol/L×2=0.2mol,n(SO42-)=0.1L×1mol/L×3=0.3mol,
Ba(OH)2溶液中:n(Ba2+)=0.1L×4mol/L×1=0.4mol,n(OH-)=0.1L×4mol/L×2=0.8mol,
由Ba2++SO42-=BaSO4↓可知,0.3molSO42-反应需要0.3molBa2+,Ba2+有剩余,0.3molSO42-完全反应,生成BaSO4为0.3mol;
由Al3++3OH-=Al(OH)3↓可知,0.2molAl3+完全反应生成Al(OH)3,需要0.6molOH-,剩余OH-为0.8mol-0.6mol=0.2mol,生成Al(OH)3为0.2mol,由Al(OH)3+OH-=AlO2-+2H2O可知,生成的0.2molAl(OH)3与剩余的0.2molOH-恰好反应,故最终固体为BaSO4为0.3mol,质量为0.3mol×233g/mol=69.9g;
故选B.
点评:本题考查离子方程式的有关计算,难度中等,清楚反应过程是解题的关键,注意过量计算判断是否有氢氧化铝生成,注意题目中硫酸根有剩余,沉淀的质量不是最大,硫酸根完全沉淀质量最大,铝离子恰好沉淀时,生成沉淀的物质的量最大.
本题难度:一般