微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在120 ℃时分别进行如下四个反应:
A.2H2S(气体)+O2=2H2O+2S↓
B.2H2S(气体)+3O2=2H2O+2SO2
C.C2H4(气体)+3O2=2H2O+2CO2
D.C4H8(气体)+6O2=4H2O+4CO2
(1)若反应在容积固定的容器内进行,反应前后气体密度(d)和气体总压强(p)分别符合关系式d前=d后和p前>p后的是________;符合关系式d前=d后和p前=p后的是________(填写反应的序号)。
(2)若反应在压强恒定、容积可变的容器内进行,反应前后气体密度(d)和气体体积(V)分别符合关系式d前>d后和V前<V后的是________;符合d前>d后和V前>V后的是________(填写反应的序号)。
(3)一定温度和压强下,混合气体对氢气的相对密度为21,则C2H4和C4H8的体积比为 ,混合气体中C2H4的质量分数为 。
参考答案:(1)B、C
(2)D、A
(3)1:1、33.
本题解析:
试题分析:(1)在容积固定的容器内,四个反应的反应物和生成物中除硫单质外均为气体,所以反应B、C、D均符合d前=d后的关系式.反应B反应后气体物质的量减少,根据气态方程可知
p前>p后后,而反应C反应前后气体物质的量没有变化,符合P前=P后,故答案为:B;C;
(2)如果保持压强恒定,反应物和生成物均为气体时,气 体的密度与气体的体积成反比,即若符合关系式d前>d后,一定满足V前<V后,所以只要反应后气体物质的量增大的就满足上述题意.即D为答案.而关系式d前>d后和V前>V后同时成立,则反应中必有非气体物质存在.只有反应A有固态物质硫存在,且反应物H2S和O2的任一种气体的密度均大于生成物水蒸气的密度(在相同条件下相对分子质量大的气态物质密度大),以及反应前后气体物质的量减少,符合V前>V后,故答案为:D;A.(3)混合气体对氢气的相对密度为21,则混合气体的相对分子质量为42,则用十字交叉法分析C2H4和C4H8的体积比为,则体积比为1:1,C2H4的质量分数为28/(28+56)=33.3%。
考点:阿伏伽德罗定律和十字交叉法。
本题难度:一般
2、选择题 设NA为阿伏加德罗常数,下列说法错误的是
A.16.9gBaO2固体中阴、阳离子总数为0.3NA
B.2.3g钠被O2完全氧化时,失去电子数为0.1NA
C.l?L?0.1mol?L-1CH3COONa溶液中,CH3COOH分子和CH3COO-离子的总数为0.1NA
D.Fe与标准状况下22.4?LCl2点燃恰好完全反应后,Fe失去电子总数为2NA
参考答案:A
本题解析:分析:A、1molBaO2固体中含有1mol钡离子和1mol过氧根离子;
B、根据电子守恒,1mol钠完全反应失去1mol电子;
C、根据物料守恒,1mol醋酸钠溶液中CH3COOH分子和CH3COO-离子的总物质的量是1mol;
D、铁与氯气反应生成的是氯化铁,根据氯气的物质的量计算转移的电子.
解答:A、16.9gBaO2固体的物质的量是0.1mol,含有0.1mol钡离子和0.1mol过氧根离子,阴、阳离子总数为0.2NA,故A正确;
B、2.3g钠的物质的量是0.1mol,完全反应失去0.1mol电子,失去电子数为0.1NA,故B错误;
C、l L 0.1mol?L-1CH3COONa溶液中含有0.1mol醋酸钠,CH3COOH分子和CH3COO-离子的总数为0.1NA,故C错误;
D、标准状况下22.4 LCl2的物质的量是1mol,反应得到2mol电子,根据电子守恒,Fe失去电子总数为2NA,故D错误;
故选A.
点评:本题考查了阿伏伽德罗常数,注意1mol过氧化钡中含有2mol离子,本题难度不大.
本题难度:困难
3、选择题 设NA表示阿伏加德罗常数,下列叙述中正确的是
[???? ]
A.常温常压下,11.2L氧气所含的原子数为NA
B.1.8g的NH4+离子中含有的电子数为NA
C.常温常压下,48gO3所占的体积为22.4L
D.2.4g金属镁变为镁离子时失去的电子数为0.1NA
参考答案:B
本题解析:
本题难度:简单
4、选择题 用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.铜与足量的稀硝酸反应生成4.48L气体时,转移的电子数为0.6NA
B.将硫溶于热的浓硫酸,当生成3moLSO2时,转移的电子数为4NA
C.常温常压下,4.6g的NO2和N2O4混合气体含有的原子数为3NA
D.标准状况下,22.4L氯气与足量的氢氧化钠溶液充分反应,转移的电子数为2NA
参考答案:A、没有告诉是标准状况下,故无法求算气体的物质的量,故A错误
本题解析:
本题难度:一般
5、选择题 x?mol?CO2中含?y?个氧原子,则阿伏加德罗常数可表示为(mol-1)
A.
B.
C.
D.
参考答案:D
本题解析:分析:根据阿伏伽德罗常数的规定和意义,结合微粒数与物质的量的关系来分析计算;
解答:用NA表示阿伏加德罗常数,根据题意x?mol?CO2分子数为xNA,所以氧原子数为2xNA=y,则NA=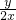 mol-1;
mol-1;
故选D.
点评:本题考查了物质的量与微粒数目、阿伏伽德罗常数间的计算关系.
本题难度:一般