微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述正确的是?????? [???? ]
A.用石墨电极电解MgCl2饱和溶液的总反应为:Mg2+?+?2Cl- Mg?+?Cl2↑
Mg?+?Cl2↑
B.精炼铜过程中阴极增重6.4g时,电路中转移电子数大于0.2NA
C.氢氧酸性燃料电池放电时,正极反应为:O2+4e-+4H+=2H2O
D.铅蓄电池在放电过程中,负极质量减小,正极质量增加
参考答案:C
本题解析:
本题难度:一般
2、填空题 ( 9分)对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)含乙酸钠和对氯酚( )的废水可以通过构成微生物电池除去,其原理如下图所示。
)的废水可以通过构成微生物电池除去,其原理如下图所示。
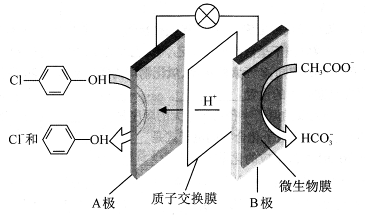
①B是电池的 极(填“正”或“负”);②A极的电极反应式为 。
(2)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如下图所示(图中“HA ”表示乳酸分子,A-表示乳酸根离子)。
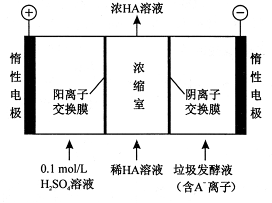
①阳极的电极反应式为 ;
②简述浓缩室中得到浓乳酸的原理 ;
③电解过程中,采取一定的措施可控制阳极室的pH约为6~8 ,此时进人浓缩室的OH-可忽略不计。400 mL10g/L 乳酸溶液通电一段时间后,浓度上升为 145g/L(溶液体积变化忽略不计),则阴极上产生的H2在标准状况下的体积约为 L(乳酸的摩尔质量为90g/ mol )。
参考答案:(1)①负;② 本题解析:
本题解析:
试题分析:(1)①由于H+向A极板移动,根据同种电荷相互排斥,异种电荷相互吸引的原则,所以B是电池的负极;②A极的电极反应式为 +H++2e-=
+H++2e-=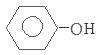 +Cl-;(2) ①在阳极溶液中的阴离子放电,由于OH-的放电能力大于含氧酸根离子,所以在阳极OH-放电,该电极的电极反应式为4OH--4e-=2H2O+O2↑;在阳极发生反应:2H++2e-=H2↑;②浓缩室中得到浓乳酸的原理是在阳极OH-放电,c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室;A-通过阴离子交换膜从阴极进入浓缩室,H++A-=HA,所以乳酸浓度增大;③反应过程中产生的乳酸的质量是0.400 L(145g/L -10g/L)=54g.则乳酸的物质的量是54g÷90g/ mol=0.6mol;因为在反应过程乳酸根离子结合的H+离子的个数与反应过程中放电的H+或OH-的个数相等,所以n(H2)=1/2n(乳酸)=0.3mol,其在标准状况下体积是0.3mol×22.4L/mol=6.72L。
+Cl-;(2) ①在阳极溶液中的阴离子放电,由于OH-的放电能力大于含氧酸根离子,所以在阳极OH-放电,该电极的电极反应式为4OH--4e-=2H2O+O2↑;在阳极发生反应:2H++2e-=H2↑;②浓缩室中得到浓乳酸的原理是在阳极OH-放电,c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室;A-通过阴离子交换膜从阴极进入浓缩室,H++A-=HA,所以乳酸浓度增大;③反应过程中产生的乳酸的质量是0.400 L(145g/L -10g/L)=54g.则乳酸的物质的量是54g÷90g/ mol=0.6mol;因为在反应过程乳酸根离子结合的H+离子的个数与反应过程中放电的H+或OH-的个数相等,所以n(H2)=1/2n(乳酸)=0.3mol,其在标准状况下体积是0.3mol×22.4L/mol=6.72L。
考点:考查电池电极的判断、电解原理的在废水处理中的应用和计算的知识。
本题难度:困难
3、选择题 某同学按图所示的装置进行电解实验。下列说法正确的是
 [???? ]
[???? ]
A.电解过程中,铜电极上有H2产生
B.电解初期,主反应方程式为:Cu+H2SO4 CuSO4+H2↑
CuSO4+H2↑
C.电解一定时间后,石墨电极上有铜析出
D.整个电解过程中,H+的浓度不断增大
参考答案:BC
本题解析:
本题难度:一般
4、选择题 如图所示,a,b,c,d均为石墨电极,通电进行电解,下列说法正确的是(??)
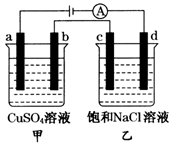
A.乙池中d的电极反应为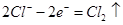
B.a,c两极产生气体的物质的量相等
C.甲、乙两池中溶液pH均保持不变
D.乙池中发生的反应为
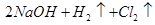
参考答案:D
本题解析:考查电解原理
甲池:2CuSO4+2H2O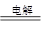 2Cu+O2↑+2H2SO4
2Cu+O2↑+2H2SO4
a极是阳极: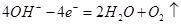 、b极为阴极:
、b极为阴极:
本题难度:一般
5、填空题 25.(12分)发展储氢技术是氢氧燃料电池推广应用的关键。研究表明液氨是一种良好的储氢物质,其储氢容量可达17.6% (质量分数)。液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池。氨气分解反应的热化学方程式如下:
2NH3(g)  N2 (g) + 3H2(g) ΔH =" +92.4" kJ·mol-1
N2 (g) + 3H2(g) ΔH =" +92.4" kJ·mol-1
请回答下列问题:
(1) 氨气自发分解的反应条件是 。(填“高温”、“低温”或“任何条件下”)
(2) 已知:2H2(g)+O2(g)=2H2O(g) ΔH =" -" 483.6 kJ·mol-1
NH3(l) NH3(g) ΔH =" +23.4" kJ·mol-1
NH3(g) ΔH =" +23.4" kJ·mol-1
则,反应4NH3(l)+3O2(g)=2N2(g)+6H2O(g)的ΔH = 。
(3) 研究表明金属催化剂可加速氨气的分解。图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。
①不同催化剂存在下,氨气分解反应的活化能最大的是 (填写催化剂的化学式)。
②恒温(T1)恒容时,用Ni催化分解初始浓度为c0的氨气,并实时监测分解过程中氨气的浓度。计算后得氨气的转化率α(NH3)随时间t变化的关系曲线(见图2)。请在图2中画出:在温度为T1,Ru催化分解初始浓度为c0的氨气过程中α(NH3) 随t变化的总趋势曲线(标注Ru-T1)。
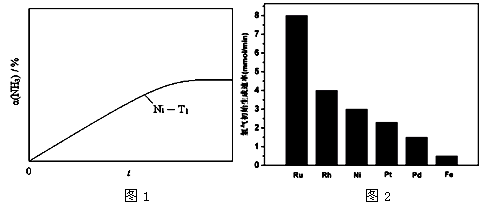
③如果将反应温度提高到T2,请在图2中再添加一条Ru催化分解初始浓度为c0的氨气过程中α(NH3) ~ t的总趋势曲线(标注Ru-T2)
(4) 用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应式是 。
(已知:液氨中2NH3(l)  NH2- + NH4+)
NH2- + NH4+)
参考答案:(1) 高温
(2) -1172.4 kJ·mol-1
本题解析:
试题分析:(1)高温有利于正反应的发生,可促进氨气的自发分解;(2)2NH3(g)  N2 (g) + 3H2(g);ΔH =" +92.4" kJ·mol-1①2H2(g)+O2(g)=2H2O(g);ΔH =" -" 483.6 kJ·mol-1②NH3(l)
N2 (g) + 3H2(g);ΔH =" +92.4" kJ·mol-1①2H2(g)+O2(g)=2H2O(g);ΔH =" -" 483.6 kJ·mol-1②NH3(l) NH3(g);ΔH =" +23.4" kJ·mol-1③;3×①+4×③-3×②="-1172.4" kJ·mol-1;(3)不同催化剂存在下,催化生成氢气的量越少,所需的活化能就越大;温度不变,使用Ru做催化剂,反应速度加快,但达到平衡时氨气的浓度相等;温度升高,使用同一种催化剂,反应速率加快,活化分子数增多,氨气的转化率增大;(4)阴极是得电子的反应,电解时氨气得电子。
NH3(g);ΔH =" +23.4" kJ·mol-1③;3×①+4×③-3×②="-1172.4" kJ·mol-1;(3)不同催化剂存在下,催化生成氢气的量越少,所需的活化能就越大;温度不变,使用Ru做催化剂,反应速度加快,但达到平衡时氨气的浓度相等;温度升高,使用同一种催化剂,反应速率加快,活化分子数增多,氨气的转化率增大;(4)阴极是得电子的反应,电解时氨气得电子。
考点:热化学方程式及相关计算、电极方程式的书写
点评:本题较有难度,关键是要掌握热化学方程式的计算和电极方程式的书写。
本题难度:困难