微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 关于原电池的叙述正确的是?
[?????]
A.构成原电池的正极和负极必须是两种不同金属
B.在理论上可将该反应:CH4(g)+2O2(g)→CO2(g)+H2O(l) ΔH<0,设计成原电池
C.在铅、银和盐酸构成的原电池工作时,铅板上有5.175 g铅溶解,正极上就有1 120 mL(标准状况)气体析出
D.原电池工作时,正极和负极上发生的都是氧化还原反应
2、选择题 电解质溶液为硫酸铜的铜锌原电池中,铜电极是
A.负极
B.发生还原反应的一极
C.正极
D.电子流入的一极
3、选择题 发生原电池的反应通常是放热反应,下列反应中可设计成原电池的是( )
A.C(s)+H2O(g)═CO(g)+H2(g);△H>0
B.Ba(OH)2?8H2O(s)+2NH4Cl(s)═BaCl2(aq)+2NH3?H2O(l)+8H2O(l);△H>0
C.2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O(l);△H<0
D.CH4(g)+2O2(g)→CO2(g)+2H2O(l);△H<0
4、选择题 化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,不正确的是
A.水解反应是典型的可逆反应,水解反应的化学平衡常数称为水解常数(用Kh表示),Na2CO3第一步水解反应的水解常数的表示式 Kh≤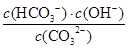
B.HS-电离的离子方程式:HS-+H2O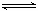 H3O++S2-
H3O++S2-
C.N2(g)+3H2(g) 2NH3(g) △H<0,其他条件不变时升高温度,反应速率V(H2)增大,氢气的平衡转化率变小
2NH3(g) △H<0,其他条件不变时升高温度,反应速率V(H2)增大,氢气的平衡转化率变小
D.CO(g)的燃烧热是283.0 kJ·mol-1,则表示CO(g)的燃烧热的热化学方程式为:
CO(g)+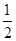 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
5、填空题 (16分)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上合成甲醇的反应原理为:CO(g) + 2H2(g)? ??CH3OH(g)? ΔH,
??CH3OH(g)? ΔH,
下表所列数据是该反应在不同温度下的化学平衡常数(K)。

①根据表中数据可判断ΔH??????0 (填“>”、“=”或“<”)。?????
②在300℃时,将2 mol CO、3 mol H2和2 mol CH3OH充入容积为1L的密闭容器中,此时反应将???????????????。
A.向正方向移动
B.向逆方向移动
C.处于平衡状态
D.无法判断
(2)已知在常温常压下:
①2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(l)?? ΔH=-1451.6 kJ·mol-1
②2CO (g)+ O2(g) = 2CO2(g)??ΔH=-566.0 kJ·mol-1
写出该条件下甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
???????????????????????????????????????????????????????。
(3)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,则负极的电极反应式为???????????????????,(3分)随着反应的不断进行溶液的pH????????(填“增大”“减小”或“不变”)。
(4)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为?????????????????????????????一段时间后NaCl溶液的体积为1L,溶液的pH为12(25℃下测定),则理论上消耗氧气的体积为???????mL(3分)(标况下)。