微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题
下列与装置有关的说法中正确的是
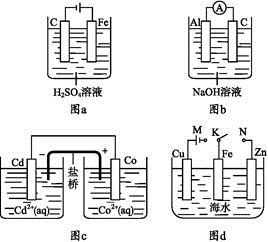
A.图a中,随着电解的进行溶液中H+的浓度越来越大
B.图b中,Al电极作电池的负极,电极反应为Al-3e- Al3+
Al3+
C.图c中,发生的反应为Co+Cd2+ Cd+Co2+
Cd+Co2+
D.图d中,K分别与M、N连接,Fe电极均受到保护不会腐蚀
参考答案:D
本题解析:
A选项,阴极电极反应:2H++2e- H2↑,阳极电极反应:Fe-2e-
H2↑,阳极电极反应:Fe-2e- Fe2+,溶液中H+的浓度越来越小,
Fe2+,溶液中H+的浓度越来越小,
本题难度:一般
2、选择题 右图为番茄制作的水果电池,下列说法正确的是
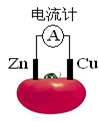
A.一段时间后,铜片质量减小
B.锌电极发生氧化反应
C.电流由锌通过导线流向铜
D.铜电极是该电池的负极
参考答案:B
本题解析:
试题分析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。锌的金属性强于铜的,所以锌是负极,铜是正极,溶液中的氢离子在正极得到电子生成氢气,所以选项B正确,其余选项都是错误的,答案选B。
点评:该题是基础性试题的考查,试题注重基础,贴近生活,有利于调动学生的学习积极性。该题的关键是明确原电池的工作原理,特别是正负极的判断以及和电极反应式的书写。
本题难度:一般
3、选择题 如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1 mol时,下列说法不正确的是
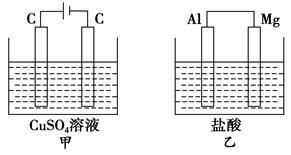
A.溶液的质量变化:甲减小乙增大
B.溶液pH变化:甲减小乙增大
C.相同条件下产生气体的体积:V甲=V乙
D.电极反应式:甲中阴极为Cu2++2e-===Cu,乙中负极为Mg-2e-===Mg2+
参考答案:D
本题解析:
试题分析:A.甲中总反应为:2CuSO4+2H2O=2Cu+2H2SO4+O2↑,乙中总反应为:Mg+2HCl=MgCl2+H2↑,故甲溶液质量减小,乙溶液质量增大,故A正确; B.甲中生成H2SO4,pH减小,乙中消耗HCl,pH增大,故B正确;C.甲中阴极为Cu2+放电,电极反应为Cu2++2e-=Cu,乙中负极为镁放电,电极反应为:Mg-2e-=Mg2+,故C正确;D.当两装置电路中通过的电子都是0.1mol时,甲中产生0.025molO2,乙中产生0.05molH2,故相同条件下,甲乙中产生气体的体积比为1:2,故D错误
考点:本题考查原电池和电解池的原理
本题难度:一般
4、选择题 已知空气、锌电池的电极反应为:锌片Zn+2OH--2e-=ZnO+H2O,石墨1/2O2十H2O+2e-=2OH-,由此判断锌片是
A.正极被还原
B.正极被氧化
C.负极被还原
D.负极被氧化
参考答案:D
本题解析:
本题难度:简单
5、选择题 原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关,下列说法中不正确的是( )
A.由Al、Cu、稀H2SO4组成原电池,放电时SO42-向Al电极移动
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-===AlO2-+2H2O
C.由Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解硝酸银溶液,当析出1 mol Ag时,消耗铜电极32 g
D.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-===Cu2+
参考答案:D
本题解析:
试题分析:A.由Al、Cu、稀H2SO4组成原电池,Al作负极,Cu作正极,根据同种电荷相互排斥,异种电荷相互吸引。所以放电时SO42-向正电荷较多的负极Al电极移动。正确。B.由Mg、Al、NaOH溶液组成原电池,Al作负极。其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O。正确。C.由Al、Cu、浓硝酸组成原电池,由于Al在浓硝酸中会发生钝化,所以Cu作负极,Al作正极。该原电池作电源,用石墨电极来电解硝酸银溶液,因为在整个闭合回路中电子转移数目相等。当析出1 mol Ag时,电子
本题难度:一般