微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 设NA为阿伏加德罗常数的值。下列说法正确的是
A.1 mol·L-1的NaCl溶液中含NA个Cl-
B.78 g 苯含3NA个双键数
C.标况下,11.2L N2与CO的混合气体中含NA个分子
D.同温同压下,2NA个C2H4(g)与NA个C4H8(g)的密度不相等
参考答案:D
本题解析:
试题分析:A、1 mol·L-1的NaCl溶液的体积不能确定,因此不能计算溶液中含有的Cl-个数,A错误;B、78 g 苯的物质的量是1mol,但苯分子中不存在碳碳双键和碳碳单键,B错误;C、标况下,11.2L N2与CO的混合气体的物质的量是11.2L÷22.4L/mol=0.5mol,则含有0.5NA个分子,C错误;D、同温同压下,气体的密度之比等于摩尔质量之比,因此2NA个C2H4(g)与NA个C4H8(g)的密度不相等,D正确,答案选D。
考点:考查阿伏伽德罗常数的计算
本题难度:一般
2、选择题 下列各组物理量中,都不随取水量的变化而变化的是 [???? ]
A.水的沸点;蒸发水所需热量
B.水的密度;水中通入足量CO2后溶液的pH
C.水的体积;电解水所消耗的电量
D.水的物质的量;水的摩尔质量
参考答案:B
本题解析:
本题难度:简单
3、选择题 0.5L 1mol/L FeCl3溶液与0.2L1mol/L KCl溶液中的Cl-的数目之比( )
A.5:2
B.3:1
C.15:2
D.1:3
参考答案:C
本题解析:
试题分析:根据物质的化学式可知,两种溶液中氯离子的浓度分别是3mol/L和1mol/L,所以溶液中氯离子的数目之比是(3x0.5)
本题难度:一般
4、实验题 (9分)实验室欲用NaOH固体配制1.0mol/L的NaOH溶液480mL:
(1)配制时,必须使用到的玻璃仪器有 、 、 、
(2) 使用容量瓶前必须进行的一步操作是_____________________
(3) 要完成本实验该同学应称出NaOH______g
(4)在配制过程中,其他操作都是正确的,下列操作会引起所配溶液浓度偏高的是__________
①称量固体药品时所用的砝码是生锈的
②称量时间过长
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度
参考答案:(1)烧杯、玻璃棒、 500mL容量瓶、胶头滴管
本题解析:
试题分析:(1)配制时需要的仪器主要有烧杯、玻璃棒、500mL容量瓶、胶头滴管。
(2)容量瓶带盖,所以使用前必须捡漏。
(3)因为没有480mL的容量瓶,所以配制过程中需要500mL容量瓶,溶质质量也要按照500mL容量瓶来计算,所以m(NaOH)=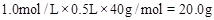 。
。
(4)根据c= 可知,砝码生锈称量的固体质量比正常值高,所以偏高,称量时间过长NaOH会变质,所以偏低,容量瓶不干燥,溶质质量和溶液体积都无影响,所以无影响,定容时俯视刻度,溶液的体积比正常值小,所以偏高,为冷却就定容,溶液冷却后溶液的体积会缩小,所以偏高,摇匀后又加水,溶液的体积比正常值大,所以偏低。因此偏高的是①④⑤。
可知,砝码生锈称量的固体质量比正常值高,所以偏高,称量时间过长NaOH会变质,所以偏低,容量瓶不干燥,溶质质量和溶液体积都无影响,所以无影响,定容时俯视刻度,溶液的体积比正常值小,所以偏高,为冷却就定容,溶液冷却后溶液的体积会缩小,所以偏高,摇匀后又加水,溶液的体积比正常值大,所以偏低。因此偏高的是①④⑤。
考点:物质的量浓度配制
点评:
本题难度:一般
5、选择题 实验室需480 mL 1.0 mol/L的NaOH溶液,假如其他操作均是准确无误的,下列情况会引起配制溶液的浓度偏高的是:
A.称取氢氧化钠20.0 g
B.定容时俯视观察刻度线
C.移液时,对用于溶解氢氧化钠的烧杯没有进行冲洗
D.移液用玻璃棒引流时,玻璃棒下端靠在容量瓶刻度线上方
参考答案:B
本题解析:
试题分析:实验室需480 mL 1.0 mol/L的NaOH溶液,实际需用500ml容量瓶配置500ml1.0mol/L的NaOH溶液,需称取NaOH质量为20.0g,故A项不会引起浓度偏高,A项错误;定容时俯视观察刻度线,使所配溶液体积<500ml,根据c(B)=n(B)/V可知会使所配溶液浓度偏高,故B项正确;移液时,对用于溶解氢氧化钠的烧杯没有进行冲洗,则使转移至容量瓶中溶质NaOH的量减少,根据c(B)=n(B)/V可知会使所配溶液浓度偏低,故C项错误;移液用玻璃棒引流时,玻璃棒下端靠在容量瓶刻度线上方,导致容量瓶刻度线以上区域沾有液体,定容后会导致溶液体积V偏大,则根据c(B)=n(B)/V可知会使所配溶液浓度偏低,故D项错误。本题选B。
考点:一定物质的量浓度溶液配制。
本题难度:一般