微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在水溶液中能量共存的一组离子是(??)
A.Na+、Ba2+、Cl-、NO3-
B.Pb2+、Hg2+、S2-、SO42-
C.NH4+、H+、S2O32-、PO43-
D.ClO-、Al3+、Br-、CO32-
参考答案:A
本题解析:A项中四种离子互不反应,所以能大量共存;B项中Pb2+、Hg2+分别与S2?反应生成PbS、HgS沉淀,故不能大量共存;C项中H+分别与S2O32?、PO43?反应,故不能大量共存;D项中Ca2+、Al3+分别与CO32?反应,故不能构成。
本题考查离子共存
本题难度:一般
2、填空题 (1)常温下,0.1 mol·L-1的醋酸和pH=1的醋酸各100 mL分别与足量的锌粒反应,产生的气体前者比后者________(填“多”、“少”或“相等”)。
(2)25℃时,将pH=5的氯化铵溶液稀释100倍,稀释后溶液的pH为________(填字母,下同)。
A.5?????? B.7?? C.3~5之间?? D.5~7之间
(3)25℃时,向0.1 mol·L-1的醋酸溶液中加入少量醋酸钠晶体,当晶体溶解后测得溶液的pH将________,醋酸的电离度?????????,醋酸的电离平衡常数???????,水的电离程度????????。
A.增大? B.减少C.不变? D.无法确定
(4)已知某温度下0.01 mol/L HCl溶液中由水电离的c(H+)=10-11 mol/L,则KW=________;若在此温度下将pH=a的NaOH溶液与pH=b的盐酸按体积比1∶100混合后二者刚好完全反应,a与b应满足的关系为________。
(5)室温下NaHCO3溶液的PH ??????7(填>、<或=),原因是(用离子方程式表示)?????????,NaHCO3溶液中离子浓度的大小顺序是????????
参考答案:(1)少?(2)D?(3)A B C A? (4) 10-1
本题解析:(1)pH=1的醋酸的物质的量浓度要远大于0.1 mol·L-1,与足量的锌粒反应,产生的氢气要多。
(2)弱酸性溶液稀释后酸性减弱,pH升高,但不会等于或超过7
(3)CH3COOH  ?CH3COO— + H+
?CH3COO— + H+
向醋酸溶液中加入少量醋酸钠晶体,平衡左移,电离度减小, H+减小,酸性减小,水的
本题难度:一般
3、选择题 下列反应既是离子反应又是氧化还原反应的是?????(????????)
A.NaOH溶液和FeSO4溶液
B.AgNO3溶液和过量的NH3·H2O
C.Na2SO3溶液和酸性KMnO4溶液
D.Na2S溶液与稀H2SO4
参考答案:C
本题解析:四个反应皆为离子反应,但
A、FeSO4+2NaOH=Na2SO4+Fe(OH)2↓复分解反应,非氧化还原反应;
B、AgNO3+2NH3·H2 O=[Ag(NH3)2]NO3+2H2O络合反应,非氧化还原反应;
C、5Na2SO3+2KMnO4+3H2SO4=5Na2SO4+K2SO4+2MnSO4+3H2O氧化还原反应;
D、Na2S+H2SO4=Na2SO4+H2S↑复分解反应,非氧化还原反应。
本题难度:一般
4、选择题 下列各组离子在溶液中能大量共存的是 ( )
A.Ba2+、C1-、 、K+
、K+
B.Fe3+、OH-、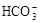 、Na+
、Na+
C.Ca2+、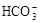 、C1-、K+
、C1-、K+
D.H+、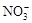 、ClO-、K+
、ClO-、K+
参考答案:C
本题解析:
试题分析:离子间如果发生化学反应,则不能大量共存,反之是可以的。A中能生成硫酸钡白色沉淀;B中OH-和Fe3+以及HCO3-都不能大量共存;D中H+和ClO-不能大量共存,所以正确的答案选C。
考点:考查离子共存的正误判断
点评:离子不能大量共存的一般情况是:(1)能发生复分解反应的离子之间(即生成沉淀,气体,水、弱酸、弱碱等难电离物质);(2)能生成难溶物的离子之间(如:Ca2+和 SO42-;Ag+和 SO42-);(3)能完全水解的离子之间,如多元弱酸和弱碱盐的阴、阳离子(如:Al3+, Fe3+与 CO32-、HCO3-、AlO2-等);(4)能发生氧化还原反应的离子之间(如:Fe 、H+、NO3-;S2-、ClO-;S2-、 Fe3+等);(5)能发生络合反应的离子之间(如 Fe3+和 SCN-);解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有:(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可排除 Cu2+、 Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;(4)是“可能”共存,还是“一定”共存等。
本题难度:一般
5、实验题 (16分)某化学兴趣小组在课外活动中,对某溶液进行了三次检验,每次检验结果如下表所示,请回答下列问题。