微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)【化学—化学与技术】
碘酸钾是一种白色结晶,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘;在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560 ℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:6I2 +11KClO3 +3H2O=6KH(IO3)2 + 5KCl + 3Cl2
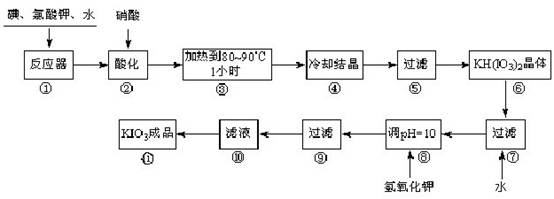
试回答下列问题:
(1)步骤①反应器发生的反应中,转移电子总数为___________;
(2)步骤②中,用硝酸而不用HI,其原因可能是______________________;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为________;
(4)步骤⑧用氢氧化钾调节溶液的pH,反应的化学方程式为:________;
2、选择题 下图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色。下列说法中正确的是( )。
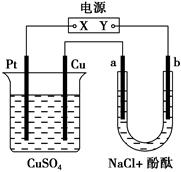
A.X是正极,Y是负极
B.X是负极,Y是正极
C.CuSO4溶液的pH逐渐变小
D.CuSO4溶液的pH不变
3、选择题 元素“氦、铷、铯”等是用下列哪种科学方法发现的:
A.红外光谱
B.质谱
C.原子光谱
D.核磁共振谱
4、选择题 化工生产必须在遵循科学原理、实现某个反应的基础上,着重考虑综合经济效益。从硫酸工业遵循的科学原理和综合经济效益分析,下列说法不正确的是( )。
A.硫酸厂不应建在人口稠密的居民区和环保要求高的地区
B.硫酸厂靠近原料产地比靠近硫酸消费中心更为有利
C.硫酸厂生产过程中的污水,含有硫酸等杂质,可用石灰乳中和处理
D.可利用硫酸厂生产过程中产生的“废热”来供热和发电
5、填空题 利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下。
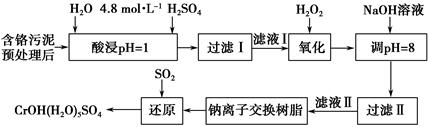
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L-1的浓硫酸配制250 mL 4.8 mol·L-1的H2SO4溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需_______________________ _。
(2)酸浸时,为了提高浸取率可采取的措施有_____________________________
______________________________________________________(答出两点)。
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72—,写出此反应的离子方程式:_____________________________________________________________。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子
| Fe3+
| Mg2+
| Al3+
| Cr3+
|
开始沉淀时的pH
| 2.7
| -
| -
| -
|
沉淀完全时的pH
| 3.7
| 11.1
| 8
| 9(>9溶解)
?
加入NaOH溶液使溶液呈碱性,Cr2O72—转化为CrO42—。滤液Ⅱ中阳离子主要有________;但溶液的pH不能超过8,其理由是_________________________。
(5)钠离子交换树脂的反应原理为Mn++nNaR―→MRn+nNa+,利用钠离子交换树脂除去的滤液Ⅱ中的金属阳离子是_______________________________。
(6)写出上述流程中用SO2进行还原时发生反应的化学方程式:__________________________________________________。
|