微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法中正确的是[???? ]
A.光导纤维、棉花、油脂、ABS树脂都是由高分子化合物组成的物质
B.开发核能、太阳能等新能源,推广基础甲醇汽油,使用无磷洗涤剂都可直接降低碳排放
C.红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析
D.阴极射线、 -粒子散射现象及布朗运动的发现都对原子结构模型的建立作出了贡献
-粒子散射现象及布朗运动的发现都对原子结构模型的建立作出了贡献
参考答案:C
本题解析:
本题难度:简单
2、填空题 (8分)【化学—化学与技术】
碘酸钾是一种白色结晶,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘;在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560 ℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:6I2 +11KClO3 +3H2O=6KH(IO3)2 + 5KCl + 3Cl2
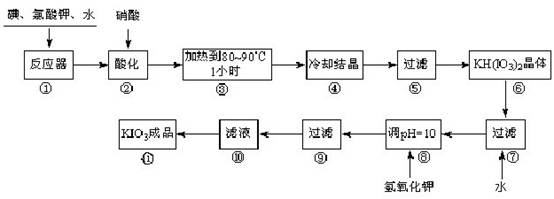
试回答下列问题:
(1)步骤①反应器发生的反应中,转移电子总数为___________;
(2)步骤②中,用硝酸而不用HI,其原因可能是______________________;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为________;
(4)步骤⑧用氢氧化钾调节溶液的pH,反应的化学方程式为:________;
参考答案:(1)60(2分)???
(2)HI具有还原性,能将已
本题解析:本题解题的关键是读懂题意,了解题目相关信息,运用氧化还原反应理论来解决。KIO3,既有氧化性又有还原性,这就要求在制备过程中要防氧化、防还原;且在常温稳定,高温分解,就要防高温。
本题难度:一般
3、选择题 海水是镁的主要来源之一。从海水中提取镁可按如下步骤进行:
①把贝壳制成石灰乳;
②在引入的海水中加入石灰乳,沉降、洗涤、过滤沉淀物;
③将沉淀物与盐酸反应,结晶、过滤、干燥产物;
④电解得到产物。
下列关于提取镁的说法中,不正确的是( )。
A.此法的优点之一是原料取自大海
B.进行①②③步骤的目的是富集MgCl2
C.可用电解熔融氧化镁的方法制取镁
D.电解法冶炼金属要消耗大量的电能
参考答案:C
本题解析:有关反应方程式:CaCO3 CaO+CO2↑,CaO+H2O=Ca(OH)2,MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓,Mg(OH)2+2HCl=MgCl2+2H2O,MgCl2
CaO+CO2↑,CaO+H2O=Ca(OH)2,MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓,Mg(OH)2+2HCl=MgCl2+2H2O,MgCl2 本题难度:简单
本题难度:简单
4、填空题 利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下。
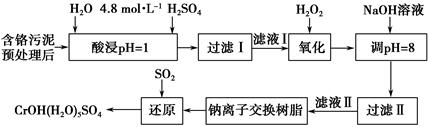
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L-1的浓硫酸配制250 mL 4.8 mol·L-1的H2SO4溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需_______________________ _。
(2)酸浸时,为了提高浸取率可采取的措施有_____________________________
______________________________________________________(答出两点)。
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72—,写出此反应的离子方程式:_____________________________________________________________。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子
| Fe3+
| Mg2+
| Al3+
| Cr3+
|
开始沉淀时的pH
| 2.7
| -
| -
| -
|
沉淀完全时的pH
| 3.7
| 11.1
| 8
| 9(>9溶解)
?
加入NaOH溶液使溶液呈碱性,Cr2O72—转化为CrO42—。滤液Ⅱ中阳离子主要有________;但溶液的pH不能超过8,其理由是_________________________。
(5)钠离子交换树脂的反应原理为Mn++nNaR―→MRn+nNa+,利用钠离子交换树脂除去的滤液Ⅱ中的金属阳离子是_______________________________。
(6)写出上述流程中用SO2进行还原时发生反应的化学方程式:__________________________________________________。
参考答案:(1)250 mL容量瓶、胶头滴管
(2)升高反应温度
本题解析:(1)结合一定物质的量浓度的溶液的配制步骤即可写出缺少的玻璃仪器,注意容量瓶必须注明规格。(4)加入NaOH溶液调节pH=8,Fe3+、Al3+以Fe(OH)3、Al(OH)3形式沉淀下来,溶液中还有Mg2+、Ca2+及加入的Na+。(5)运用钠离子交换树脂的目的是除去滤液Ⅱ中的Mg2+、Ca2+。
本题难度:困难
5、计算题 (8分)白云石化学式是CaCO3·xMgCO3。
(1)称取27.6 g白云石,高温加热到质量不再变化,收集到CO2的体积为6.72 L(标准状况)。计算白云石的化学式中x的值。
(2)将上述收集到的6.72 L CO2通入200 mL 2.25 mol·L-1NaOH溶液中,充分反应。反应后溶液中溶质的成分是(写化学式)__________________,其物质的量之比为________。
参考答案:(1)白云石的化学式中x的值为1。
(2)Na2CO3
本题解析:(1)
CaCO3·xMgCO3CaO+xMgO+(1+x)CO2
(100+84x) g 22.4(1+x) L
27.6 g??????????????????????6.72 L
=
x=1
(2)由白云石成分为CaCO3·xMgCO3,可看作CaCO3和MgCO3组成的混合物,加热时均分解,其产物CO2与NaOH溶液反应时可生成Na2CO3、NaHCO3或Na2CO3和NaHCO3的混合物,根据钠守恒和碳元素守恒进行计算。
本题难度:一般
|