微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法中,正确的一组是
①两种元素组成的共价化合物的分子中的化学键都是极性键
②两种不同非金属元素的原子之间形成的化学键都是极 性键
性键
③分子晶体中相对分子质量越大则熔沸点越高
④只要是离子化合物,其熔点就比共价化合物的熔点高
⑤离子化合物中一定含有离子键
⑥分子内可能没有共价键
⑦共价化合物形成的晶体一定是分子晶体
⑧原子晶体中一定有非极性共价键
A.只有②⑤⑥⑦
B.只有②⑤⑥
C.只有①②③⑤⑥⑧
D.只有②③⑤⑥⑦
2、填空题 (共计12分)
A.锌是一种重要的金属,锌及其化合物有着广泛的应用。
(1)葡萄糖酸锌[CH2OH(CHOH4COO)2Zn是目前市场上流行的补锌剂。写出Zn2+基
态电子排布式??????????????????????;葡萄糖[CH2OH(CHOH)4CHO]分子中碳原子杂化方式是?????????????????????????。
(2)Zn2+也能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3分子空间构型为??????;
在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在下图中
表示[Zn(NH3)4]2+中Zn2+与N之间的化学键???????。

(3)下图表示锌与某种元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为???????;
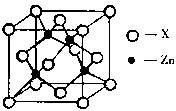
该化合物的晶体熔点比干冰高得多,原因是?????。
3、选择题 萤石(CaF2)晶体属于立方晶系,萤石中每个Ca2+被8个F-所包围,则每个F-周围最近距离的
Ca2+数目为 [???? ]
A.2
B.4
C.6
D.8
4、选择题 下列关于晶体的性质叙述中,不正确的是 [???? ]
A.晶体的自范性指的是在适宜条件下晶体能够自发地呈现封闭规则的多面体几何外形
B.晶体的各向异性和对称性是矛盾的
C.晶体的对称性是微观粒子按一定规律作周期性的有序排列的必然结果
D.晶体的各向异性直接取决于微观粒子的排列具有特定的方向性
5、填空题 (1) 已知在一定条件下的反应4HCl+O2=2Cl2 +2H2O中, 有4mol HCl被氧化时,放出120kJ的热量,且
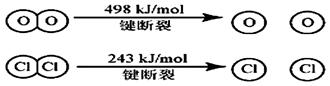
则断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差为__________KJ。
(2)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
晶体
| NaCl
| KCl
| CaO
|
晶格能/(kJ·mol-1)
| 786
| 715
| 3401
四种晶体NaCl、KCl、MgO、CaO熔点由高 到低的顺序是????????????????????????。?
(3)已知AlCl3熔点190℃,沸点183℃,结构如右图所示:AlCl3晶体内含有的作用力有?(填序号)。
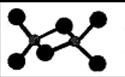
A.离子键??? B.共价键????C.金属键??
D.配位键 ???E.范德华力??? F. 氢键
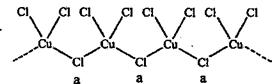
(4)氯和钾与不同价态的铜可生成两种化合物,这两种化合物中的阴离子均为无限长链结构(如下图),a位置上Cl原子的杂化轨道类型为??????,已知其中一种化合物的化学式为KCuCl3,另一种的化学式为?????????????。
|