微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1?mol氢气中的化学键消耗的能量为Q1KJ,破坏1?mol氯气中的化学键消耗的能量为Q2KJ,形成1?mol氯化氢中的化学键释放的能量为Q3KJ,则下列关系式中一定正确的是
A.Q1+Q2<2Q3
B.Q1+Q2>2Q3
C.Q1+Q2<Q3
D.Q1+Q2=Q3
参考答案:A
本题解析:氢气燃烧是放热反应,△H小于0。而反应热就是断键吸收的能量与形成化学键所放出的能量的差值,所以Q1+Q2-2Q3=△H<0,选项A正确,答案选A。
本题难度:简单
2、选择题 甲醛、乙醛、丙醛组成的混合物中,氢元素的质量分数是9%,则氧元素的质量分数是:
A.16%
B.37%
C.48%
D.无法计算
参考答案:B
本题解析:三种物质的通式都是CnH2nO,即分子中碳和氢原子的质量之比始终满足6︰1,所以混合物中含碳量是9%×6=54%,因此含氧量是1-9%-54%=37%,答案选B。
本题难度:简单
3、选择题 SF6是一种优良的气体绝缘材料,分子结构中只存在S—F键。发生反应的热化学方程式为:S(s)+ 3F2(g) = SF6(g) ΔH=" -1220" kJ/mol。已知:1mol S(s)转化为气态硫原子吸收能量280kJ,断裂1mol F—F键需吸收的能量为160 kJ,则断裂1mol S—F键需吸收的能量为
A.330 kJ
B.276.67 kJ
C.130 kJ
D.76.67 kJ
参考答案:A
本题解析:试题分析:反应热就是断键吸收的能量和形成化学键所放出的能量的差值,则根据反应式可知280 kJ/mol+3×160 kJ/mol-6×x kJ/mol=-1220 kJ/mol,解得x=330 kJ/mol,答案选A。
考点:考查反应热的应该应用与计算
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生解题能力与方法的培养和训练,有利于提高学生灵活运用基础知识解决实际问题的能力。该题的关键是明确反应热与化学键键能的关系,然后灵活运用即可。
本题难度:一般
4、选择题 制备氯乙烷的方法合理的是
A.乙烯与氯化氢加成
B.等量的乙烷与氯气取代
C.乙烯与氯气加成
D.乙烯加氢后再氯代
参考答案:A
本题解析:制备氯乙烯时,主要是利用乙烯与氯化氢的加成即可得到氯乙烯。如果采用已烷与氯气取代,则得到的产物不仅有一氯代物,还有二氯代物、三氯代物。。。。。。?所以乙烷和氯气取代,得不到纯净的氯乙烷;如果乙烯和氯气加成,则得到的是1,2—二氯乙烷;乙烯加氢后得到乙烷,在氯代,得到的产物等同于和B项一致。故只有选A。
本题难度:一般
5、选择题 同温同压下,16.5g气体X的体积与12gO2的体积相同,则X为
A.CO
B.CH4
C.CO2
D.SO2
参考答案:C
本题解析:试题分析:同温同压下,气体的体积之比等于物质的量之比,即16.5g气体X的物质的量与12gO2的物质的量相等,设X的摩尔质量为M,则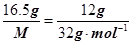 ,求得M=44g·mol–1。故X为CO2。
,求得M=44g·mol–1。故X为CO2。
考点:考查阿伏加德罗定律的推论。
本题难度:一般