微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质的分离(或提纯)方法正确的是
A.除去氯化钠溶液中的泥沙——蒸馏
B.分离乙酸与乙酸乙酯——萃取
C.用四氯化碳提取溴水中的溴单质——过滤
D.分离汽油和水——分液
参考答案:D
本题解析:A错,除去氯化钠溶液中的泥沙用过滤法;B错,分离乙酸与乙酸乙酯用洗气法,通过饱和的碳酸钠溶液除去乙酸;C错,用四氯化碳提取溴水中的溴单质——分液;D正确;
本题难度:一般
2、实验题 某综合实践活动小组到自来水厂进行参观,了解到源水处理成自来水的工艺流程示意图如下:
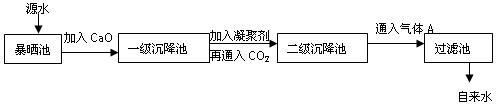
⑴源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入CaO后生成Ca(OH)2,进而发生若干复分解反应,试写出其中的一个离子方程式??????????????????????????????????????????????。
⑵加入凝聚剂可以除去其中的悬浮固体颗粒,其过程是??????????。(填写下列各项的序号)①只有物理过程,无化学过程??②只有化学过程,无物理过程?③既有化学过程又有物理过程;
FeSO4·7H2O是常用的凝聚剂,加入后,最终生成红褐色胶状沉淀,则这种红褐色胶状沉淀是????????。用化学反应方程式表示实验室制备该胶体的方法:???????????????????
⑶通入二氧化碳的目的是??????????????????????和????????????????????。
⑷气体A的作用是????????????????????????????????????????????????。
⑸下列物质中,??????????可以作为气体A的代替品。(填写下列各项的序号)
①ClO2?????????②浓氨水????? ③SO2???????????????????④浓硫酸
参考答案:⑴只要写出下列4个离子方程式中的任意一个,即可。
HC
本题解析:略
本题难度:简单
3、填空题 硼、镁及其化合物在工农业生产中应用广泛。
已知:硼镁矿主要成分为Mg2B2O5?H2O,硼砂的化学式为Na2B4O7?10H2O。利用硼镁矿制取金属镁及粗硼的工艺流程为:

回答下列有关问题:
(1)硼砂中B的化合价为????????,溶于热水后,常用H2SO4调pH2~3制取H3BO3,反应的离子方程式为?????????????。X为H3BO3晶体加热脱水的产物,其与Mg制取粗硼的化学方程式为???????????????。
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是???????????????????????????。若用惰性电极电解MgCl2溶液,其阴极反应式为 ????????????????。
(3)镁-H2O2酸性燃料电池的反应机理为Mg+H2O2+2H+==Mg2++2H2O,则正极反应式为??????????????????。若起始电解质溶液pH=1,则pH=2时溶液中Mg2+离子浓度为???????。已知Ksp[Mg(OH)2]=5.6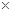 10-12,当溶液pH=6时???????(填“有”或“没有”)Mg(OH)2沉淀析出。
10-12,当溶液pH=6时???????(填“有”或“没有”)Mg(OH)2沉淀析出。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将??? 0.020g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1 Na2S2O3(H2S2O3为弱酸)溶液滴定至终点,消耗Na2S2O3溶液18.00mL。盛装Na2S2O3溶液的仪器应为???????滴定管(填“酸式”或“碱式”)。该粗硼样品的纯度为 ??????。(提示:I2+2S2O32-=2I-+S4O62-)
参考答案:(1)+3(2分) B4O72-+2H++5H2O= 4H3
本题解析:
试题分析:(1)根据硼砂的化学式Na2B4O7?10H2O和化合价的代数和为0,可得B的化合价为+3;B4O72-与2H+反应可得H3BO3,离子方程式为:B4O72-+2H++5H2O= 4H3BO3;X为H3BO3晶体加热脱水的产物,为B2O3,与Mg发生氧化还原反应,化学方程式为:Mg+B2O3===2B+3MgO。
(2)MgCl2为强酸弱碱盐,能发生水解反应,所以MgCl2·7H2O在HCl氛围中加热的目的是:防止MgCl2水解生成Mg(OH)2;用惰性电极电解MgCl2溶液,阴极反应为H2O电离出的H+放电,电解方程式为:2H2O+Mg2++2e-= H2↑+Mg(OH)2↓
(3)镁-H2O2酸性燃料电池的正极为H2O2放电,电极方程式为:H2O2+2H++2e-=2H2O;起始电解质溶液pH=1,pH=2时反应的H+为:0.1mol?L?1—0.01mol?L?1=0.09mol?L?1,根据Mg+H2O2+2H+==Mg2++2H2O,可得Mg2+离子浓度为0.045 mol·L-1;溶液pH=6时,c(OH?)=10-8mol?L?1,Q [Mg(OH)2]=" 0.045" mol·L-1×[10-8mol?L?1]2=4.5×10-18 < Ksp[Mg(OH)2],所以没有Mg(OH)2沉淀析出。
(4)Na2S2O3为强碱弱酸盐,水解显碱性,所以Na2S2O3溶液应盛放在碱式滴定管内;根据元素守恒和离子方程式可得:2B ~ 2BI3 ~ 3I2 ~ 6 S2O32-,所以粗硼样品的纯度为:0.018L×0.30mol?L?1×1/3×11g/mol÷×100% = 99%
本题难度:困难
4、选择题 a L硫酸铝溶液中含铝离子b mol,则溶液中硫酸根离子的物质的量浓度为
A.3b/2a mol·L-1
B.2b/3a mol·L-1
C.2b/a mol·L-1
D.3b/a mol·L-1
参考答案:A
本题解析:含铝离子b mol,可求出含硫酸根离子3b/2 mol,进而可求硫酸根离子的物质的量浓度.
本题难度:一般
5、填空题 除去下列各物质中的杂质(括号内为杂质),写出所加试剂(或方法),属离子反应的写出离子方程式.
(1)CO2(HCl)________,__________________________.
(2)KCl(K2CO3)________,________________________.
(3)CO(CO2)________,____________________________.
(4)Cu(CuO)________,____________________________.
参考答案:(1)饱和NaHCO3溶液;HCO3-+H+===CO2↑+
本题解析:
本题难度:一般