微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 过氧化钙晶体(CaO2·8H2O)呈白色,微溶于水,加热至350℃左右开
始分解放出氧气。过氧化钙可用于改善地表水质、处理含重金属粒子废水、应急供
氧等。实验室可用工业碳酸钙(含MgCO3、FeCO3等杂质)制取纯净的碳酸钙,然后再
用纯的碳酸钙制取过氧化钙,其主要流程如下:
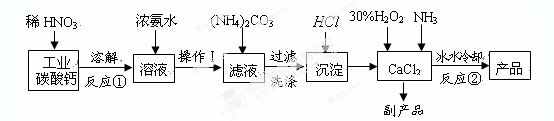
回答下列问题:
整个流程中涉及的化学反应属于氧化还原反应的有?????个,请写出其中任意一个的离子方程式:????????????????????????????????;
(2)反应②生成CaO2·8H2O的化学反应方程式为???????????????????????????????????;
反应时用冰水冷却的主要原因是????????????????????????????????????????;
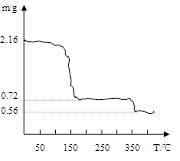
(3)将过氧化钙晶体在坩埚中加热并逐渐升高温度。测得样品质量随温度的变化如图曲线所示,则350℃以后所得固体物质的化学式为??????????????????????????????????。
2、选择题 下列过程中,涉及化学变化的是[???? ]
A.蒸馏法将海水淡化为饮用水
B.四氯化碳萃取碘水中的碘
C.过滤除去粗盐中的不溶性杂质
D.三氯化铁溶液滴入沸水中制胶体
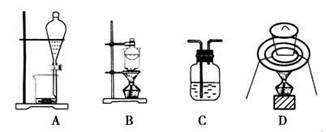
3、选择题 下列实验装置通常不用于物质分离提纯的是
4、填空题 选择下列实验方法分离物质,将分离方法的序号填在横线上。
A萃取分液法??????? B加热分解法????? C结晶法??
D分液法??????????? E蒸馏法????????? F过滤法
⑴??????分离饱和食盐水与沙子的混合物。
⑵??????从硝酸钾和氯化钠的混合溶液中获得硝酸钾。
⑶??????分离水和汽油的混合物。
⑷??????从溴的水溶液里提取溴。
5、填空题 硫酸铅广泛应用于制造蓄电池。利用锌冶炼过程中的铅浮渣生产硫酸铅的流程如下:

已知铅浮渣的主要成分是PbO、Pb,还含有少量Ag、Zn、CaO和其他不溶于硝酸的杂质。25℃时,Ksp(CaSO4)=4.9×10-5,Ksp(PbSO4)=1.6×10-8。
(1)已知步骤Ⅰ有NO产生,浸出液中含量最多的阳离子是Pb2+。分别写出PbO、Pb参加反应的离子方程式?????????????????????????????、??????????????????????????????????。
(2)步骤Ⅰ需控制硝酸的用量并使Pb稍有剩余,目的是???????????????????????????????。
(3)母液可循环利用于步骤Ⅰ,其溶质主要是????????????(填一种物质化学式),若母液中残留的SO42-过多,循环利用时可能出现的问题是????????????????????????????????????。
(4)产品PbSO4还需用Pb(NO3)2溶液多次洗涤,目的是除去??????????????????????????????。
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为???????????????????????????????????????????。